Correlation between serum N-terminal mid-fragment of osteocalcin and index of glucose metabolism after fracture
-
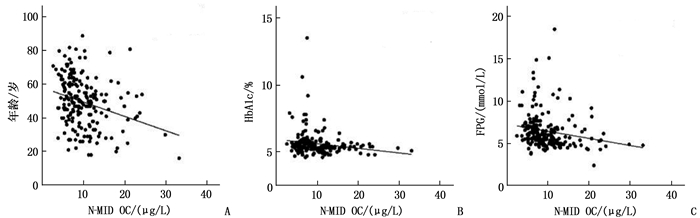
摘要:目的 探讨骨折后血清骨钙素N端中分子片段(N-MID OC)与糖化血红蛋白(HbA1c)、空腹血糖(FPG)、空腹胰岛素(FINS)、C-肽(C-P)的相关性。方法 采用回顾性研究方法, 将196例单一闭合性骨折男性患者纳入骨折组,将64例健康男性纳入健康对照组,比较2组的一般资料和生化指标水平。将骨折患者按N-MID OC四分位数分为4个亚组,比较4组患者HbA1c、FPG、FINS、C-P水平。分析血清N-MID OC水平与糖代谢指标及生化指标的相关性。结果 骨折组年龄、体质量指数、血肌酐、HbA1c与健康对照组比较,差异无统计学意义(P>0.05); 骨折组白细胞、谷丙转氨酶、谷草转氨酶、FPG、FINS、C-P水平高于健康对照组,血小板、血红蛋白、钙离子、25-羟维生素D3和N-MID OC水平低于健康对照组,差异有统计学意义(P < 0.05)。不同亚组骨折患者的年龄和血小板、FPG、N-MID OC水平比较,差异有统计学意义(P < 0.05)。相关性分析显示, N-MID OC与年龄(r=-0.280, P < 0.001)、HbA1c(r=-0.081, P=0.011)、FPG(r=-0.196, P=0.006)均呈负相关; 调整年龄因素后,多元线性回归分析显示, FPG是单一闭合性骨折患者血清N-MID OC的独立影响因素(β=-0.147, P=0.036, 95%CI为-0.663~-0.023)。结论 骨折创伤后糖代谢与血清N-MID OC存在相关性,这可能是影响骨代谢的因素。Abstract:Objective To investigate the relationships between serum N-terminal mid-fragment of osteocalcin (N-MID OC) and hemoglobin A1c(HbA1c), fasting plasma glucose(FPG), fasting insulin (FINS) and C-peptide (C-P).Methods A total of 196 male patients with single closed fracture were included in fracture group and 64 healthy men in healthy control group based on a retrospective study method, and the general data and biochemical indexes of the two groups were compared. The fracture patients were divided into four subgroups according to N-MID OC quartile, and the levels of HbA1c, FPG, FINS and C-P in four groups were compared. The correlations of serum N-Mid OC level with glucose metabolism and biochemical indexes were analyzed.Results There were no differences in age, body mass index, serum creatinine and HbA1c between the fracture group and the healthy control group (P>0.05). Leukocyte, alanine aminotransferase, aspartate aminotransferase, FPG, FINS, C-P in the fracture group were higher than those in the healthy control group, while platelets, hemoglobin, calcium ions, the levels of 25-hydroxyvitamin D3 and N-MID OC levels were lower than those of the healthy control group (P < 0.05). There were significant differences in age, platelets, FPG, and N-MID OC in the subgroups (P < 0.05). Correlation analysis showed that serum N-MID OC was negatively correlated with age (r=-0.280, P < 0.001), HbA1c(r=-0.081, P=0.011) and FPG(r=-0.196, P=0.006). After adjusting for age factor, multiple linear regression analysis showed that FPG was an independent factor affecting serum N-MID OC of patients with single closed fracture(β=-0.147, P < 0.001, 95%CI, -0.663 to -0.023).Conclusion There is a correlation between glucose metabolism and serum N-MID OC after fracture, which may be a factor affecting bone metabolism.
-
Keywords:
- fracture /
- N-terminal mid-fragment of osteocalcin /
- hemoglobin A1c /
- glucose /
- insulin /
- C-peptid
-
酒依赖为精神科最常见的物质依赖之一,是一种长期、反复的成瘾性身心疾病,临床特征是对饮酒影响的耐受性增强,对饮酒的控制能力下降,存在心理和生理危害或戒断症状和体征[1]。酒依赖患者的死亡原因多为躯体疾病,最常见的有肝脏疾病[2]、心脏疾病[3]和营养不良[4-5]等。目前,临床常用的权威营养不良风险筛查工具包括营养风险筛査(NRS)、营养不良通用筛査工具(MUST)、主观全面评定(SGA)等。相关研究[6-7]指出,MUST筛查住院患者营养不良风险相比NRS和SGA更具精准性,且具有很好的表面效度和内容效度,灵敏度、特异度较高,操作简单、耗时少,便于护士操作。本研究应用MUST对新入院酒依赖患者进行营养不良风险筛査,评估MUST的适用性及预测效能,现报告如下。
1. 资料与方法
1.1 研究资料
采用便利抽样法选择2019年11月—2020年1月本院临床心理科收治的29例新入院酒依赖患者作为研究对象,均为男性,其中1例自动出院,最终研究纳入28例。纳入标准: ①年龄≥18岁者; ②神志清楚,具有语言交流能力者; ③愿意参与本研究者。排除标准: ①未完成研究,自动出院者; ②合并严重感染者。
1.2 MUST评估方法
评估分为5个步骤: ①测量患者身高和体质量,计算体质量指数,卧床患者可测量皮褶厚度,根据表格查询对应体质量指数; ②计算非计划性体质量丧失的百分比; ③评价急性疾病或疾病的急性期对躯体的影响; ④将前3步得分相加,以确定营养不良的风险; ⑤根据总得分制订干预计划。MUST总分为0~6分,0分为低风险,1分为中风险,≥2分为高风险。低风险者无需特殊的营养治疗,中、高风险者需要制订营养治疗计划加以干预。本研究将MUST得分 < 1分者纳入对照组,将得分≥1分者纳入观察组。
1.3 观察指标
所有患者入院即接受MUST评估,评估者为责任护士(由本院营养科专家进行培训),同时使用自制调查问卷收集患者的一般资料,记录患者入院后首次检验的血钾浓度、肝功能指标丙氨酸转氨酶(ALT)或天冬氨酸转氨酶(AST)、血清总蛋白检验结果; 记录患者入院72 h内的临床表现,主要观察有无戒断症状。比较2组患者的一般资料、血液指标情况和入院72 h内的临床症状。
1.4 统计学分析
采用SPSS 20.0统计学软件分析数据,计量资料比较采用t检验,计数资料比较采用Fisher确切概率法进行检验, P < 0.05为差异具有统计学意义。
2. 结果
2.1 MUST评估结果
28例患者中, MUST得分为0分者9例(占32.14%), 1分者2例(占7.14%), ≥2分者17例(占60.71%), 即营养不良低风险者(对照组患者)占32.14%, 营养不良中或高风险者(观察组患者)占67.86%。
2.2 一般资料比较
2组患者在年龄、学历、民族、饮酒史、吸烟史、胃肠功能紊乱方面比较,差异均无统计学意义(P>0.05), 见表 1。
表 1 2组患者一般资料比较(x±s)[n(%)]指标 对照组(n=9) 观察组(n=19) 年龄/岁 45.89±11.23 42.74±8.87 学历 初中及以下 3(33.33) 4(21.05) 高中及中专 2(22.22) 5(26.32) 大专及本科 4(44.44) 10(52.63) 研究生及以上 0 0 民族 汉族 9(100.00) 15(78.95) 少数民族 0 4(21.05) 饮酒史/年 26.22±10.45 20.32±10.33 吸烟史 有 8(88.89) 13(68.42) 无 1(11.11) 6(31.58) 胃肠功能紊乱 有 3(33.33) 5(26.32) 无 6(66.67) 14(73.68) 2.3 血液指标情况比较
2组患者血钾浓度情况比较,差异无统计学意义(P>0.05); 观察组肝功能异常率和血清总蛋白异常率均高于对照组,差异有统计学意义(P < 0.05), 见表 2。
表 2 2组患者入院首次检测血液指标情况比较[n(%)]组别 n 血钾浓度 肝功能 血清总蛋白 正常 低下 正常 异常 正常 异常 对照组 9 9(100.00) 0 7(77.78) 2(22.22) 8(88.89) 1(11.11) 观察组 19 15(78.95) 4(21.05) 7(36.84)* 12(63.16)* 9(47.37)* 10(52.63)* 与对照组比较, *P < 0.05。 2.4 入院72 h内临床症状比较
入院72 h内,对照组患者均未出现戒断症状,观察组出现戒断症状11例,观察组戒断症状发生率(57.89%)高于对照组,差异有统计学意义(P < 0.05)。
3. 讨论
酒依赖患者的营养不良表现常被人们忽视[8], 若在患者新入院时未能加以重视并积极干预,很可能会诱发Wernicke-Korsakoff综合征、院内感染,甚至引起癫痫发作和谵妄,不仅延长患者的卧床时间和住院时间,加重经济负担,还会升高病死率[9]。分析原因,酒依赖患者长期大量饮酒,使得长期饮食中营养密集型食物的摄入减少,加上营养物质的消化、吸收、代谢和利用过程受到影响,故而患者全身多个器官受到损害。目前,关于酒依赖患者营养不良的定性及定量研究尚较少见。MUST是由英国肠外肠内营养学会多学科营养不良咨询小组开发的营养风险筛查工具,主要用于评估患者是否存在蛋白质-热量营养不良风险,优点是具有很好的信度与效度,且操作简单。但MUST也存在一些缺点,若患者卧床或有水肿、腹腔积液等影响体质量测量的情况以及意识不清时,该工具的使用将受到限制。本研究筛查了新入院酒依赖患者的营养不良风险状况,并评估MUST是否能够准确筛查酒依赖患者的营养不良风险。
相关研究[10]将NRS应用于酒依赖患者中,评估结果提示营养不良者约占37.55%。国外研究[11]表明,处于戒断期的住院酒依赖患者中, 53%的患者被确定有营养不良中风险或高风险。本研究应用MUST筛查酒依赖患者营养不良风险的结果提示,存在营养不良中、高风险者约占67.86%, 略高于其他研究。这可能与患者的居住地及生活水平不同有关,也可能与本研究样本量较少有关,还可能与研究者使用的评估工具不同有关。本研究结果还显示,观察组入院72 h内戒断症状发生率高于对照组,差异有统计学意义(P < 0.05), 与相关研究[9]结论一致。由此提示,营养不良很可能会导致戒断症状的发生。护士若在患者新入院时即进行MUST评估,可提升护理安全预警能力,做到心中有数,预防在先,从而减少安全隐患。
MUST可能具有预测酒依赖患者肝功能及血清总蛋白是否正常的能力,本研究中2组患者血钾浓度比较,差异无统计学意义(P>0.05), 但观察组肝功能异常率和血清总蛋白异常率均高于对照组,差异有统计学意义(P < 0.05), 与相关研究[10, 12]结果相似。在患者新入院时进行MUST评估,可帮助护士对患者实施饮食护理及生活指导,并制订个性化的健康教育计划。研究[13-14]指出,酒依赖患者的营养支持计划应贯穿住院全过程,包括鼓励进食,提供补充剂(硫胺素、氨基酸等),确保水分摄入充足,并持续监测营养状况。护理人员不仅应关注患者的电解质水平,还应关注患者有无饮食摄入量较少情况或再喂养综合征发生风险,必要时可请营养师协助确认再喂养综合征风险并提供针对性建议。以食物为基础的饮食模式[15], 结合社会心理学方面的干预,可为患者带来长期的可持续健康结果。
综上所述,新入院酒依赖患者的营养不良发生风险较高, MUST可较准确地预测患者肝功能、血总蛋白及72 h内戒断症状。将MUST作为酒依赖患者新入院时的营养不良风险筛查工具使用,可对护理工作起到预警作用。本研究仍存在一定局限性,如样本量不够大,日后还应扩大样本量进一步深入探讨,如何对营养不良中、高风险患者进行合理的营养干预也是日后研究的重点。
-
表 1 骨折组和健康对照组一般资料比较(x±s)
指标 骨折组(n=196) 健康对照组(n=64) 年龄/岁 49.59±15.03 48.18±13.54 BMI/(kg/m2) 22.15±1.83 22.65±1.73 白细胞(×109/L) 9.77±3.20* 6.99±2.33 血小板(×109/L) 149.62±70.48* 195.32±66.91 血红蛋白/(g/L) 100.65±21.04* 129.98±17.91 ALT/(U/L) 63.98±50.05* 38.76±19.38 AST/(U/L) 85.13±124.02* 43.54±22.10 钙离子/(mmol/L) 2.02±0.15* 2.20±0.21 血肌酐/(umol/L) 61.37±24.39 57.42±15.36 HbA1c/% 5.61±0.92 5.52±0.58 FPG/(mmol/L) 6.47±2.10* 5.37±0.57 FINS/(mIU/L) 12.05±8.97* 7.53±2.52 C-P/(pmol/L) 3.07±1.74* 1.92±0.53 N-MID OC/(μg/L) 9.88±4.91* 23.88±8.25 25(OH)VD3/(nmol/L) 17.74±8.72* 26.11±5.58 BMI: 体质量指数; ALT: 谷丙转氨酶; AST: 谷草转氨酶;
HbA1c: 糖化血红蛋白; FPG: 空腹血糖; FINS: 空腹胰岛素;
C-P: C-肽; N-MID OC: 骨钙素N端中分子片段;
25(OH)VD3: 25-羟维生素D3。与健康对照组比较, *P < 0.05。表 2 骨折患者N-MID OC四分位数分组一般资料比较(x±s)
指标 低值组(n=49) 中低值组(n=49) 中高值组(n=49) 高值组(n=49) 年龄/岁 55.04±14.57*# 51.30±14.14 47.93±15.17 44.08±14.42 白细胞/(×109/L) 9.80±3.68 9.99±3.17 8.97±2.25 10.32±3.44 血小板/(×109/L) 159.04±76.80 126.02±58.37#△ 151.59±57.66 161.81±82.07 血红蛋白/(g/L) 96.95±23.01 104.57±18.66 103.81±23.14 97.26±18.29 ALT/(U/L) 50.71±55.96 76.65±93.02 44.14±21.08 84.42±165.13 AST/(U/L) 92.10±125.86 85.85±124.46 62.34±46.81 100.24±167.79 钙离子/(mmol/L) 2.00±0.17 2.05±0.16 2.04±0.13 1.99±0.15 血肌酐/(μmol/L) 65.28±36.05 59.59±18.32 57.91±17.60 62.69±20.94 HbA1c/% 5.66±0.95 5.96±1.36*# 5.44±0.46 5.38±0.47 FPG/(mmol/L) 6.76±1.79 7.02±2.15*# 6.00±1.78 6.10±2.51 FINS/(mIU/L) 12.13±10.02 12.49±7.15 11.41±7.70 12.15±10.75 C-P/(pmol/L) 2.90±1.31 3.19±1.51 3.15±1.99 3.04±2.07 25(OH)VD3/(nmol/L) 17.36±6.10 17.62±6.90 18.42±9.90 17.56±11.20 ALT: 谷丙转氨酶; AST: 谷草转氨酶; HbA1c: 糖化血红蛋白; FPG: 空腹血糖; FINS: 空腹胰岛素; C-P: C-肽;
25(OH)VD3: 25-羟维生素D3。与中高值组比较, *P < 0.05; 与高值组比较, #P < 0.05; 与低值组比较, △P < 0.05。表 3 多元线性回归分析血清N-MID OC水平与HbA1c、FPG的相关性
组别 HbA1c FPG β P 95%CI β P 95%CI 未调整组 -0.181 0.011 -1.708~-0.221 -0.196 0.006 -0.781~-1.134 调整年龄组 -0.132 0.060 -1.439~0.030 -0.147 0.036 -0.663~-0.023 HbA1c: 糖化血红蛋白; FPG: 空腹血糖。 -
[1] PICKE A K, CAMPBELL G, NAPOLI N, et al. Update on the impact of type 2 diabetes mellitus on bone metabolism and material properties[J]. Endocr Connect, 2019, 8(3): R55-R70. doi: 10.1530/EC-18-0456
[2] FERRON M, WEI J, YOSHIZAWA T, et al. Insulin signaling in osteoblasts integrates bone remodeling and energy metabolism[J]. Cell, 2010, 142(2): 296-308. doi: 10.1016/j.cell.2010.06.003
[3] WEI J, FERRON M, CLARKE C J, et al. Bone-specific insulin resistance disrupts whole-body glucose homeostasis via decreased osteocalcin activation[J]. J Clin Invest, 2014, 124(4): 1-13.
[4] MOSER S C, VAN DER EERDEN B C J. Osteocalcin-A versatile bone-derived hormone[J]. Front Endocrinol: Lausanne, 2018, 9: 794.
[5] NAGASUE K, INABA M, OKUNO S, et al. Serum N-terminal midfragment vs. intact osteocalcin immunoradiometric assay as markers for bone turnover and bone loss in hemodialysis patients[J]. Biomed Pharmacother, 2003, 57(2): 98-104. doi: 10.1016/S0753-3322(02)00344-X
[6] TANIGUCHI T, MATSUMOTO T, SHINDO H. Changes of serum levels of osteocalcin, alkaline phosphatase, IGF-I and IGF-binding protein-3 during fracture healing[J]. Injury, 2003, 34(7): 477-479. doi: 10.1016/S0020-1383(02)00380-7
[7] JESCHKE M G, BOEHNING D. Endoplasmic Reticulum stress and insulin resistance post-trauma: similarities to type 2 diabetes[J]. J Cell Mol Med, 2012, 16(3): 437-444. doi: 10.1111/j.1582-4934.2011.01405.x
[8] CHEN Y, ZHAO Q, DU G, et al. Association between serum osteocalcin and glucose/lipid metabolism in Chinese Han and Uygur populations with type 2 diabetes mellitus in Xinjiang: two cross-sectional studies[J]. Lipids Health Dis, 2017, 16(1): 139. doi: 10.1186/s12944-017-0512-8
[9] DU J, PAN X, LU Z, et al. Serum osteocalcin levels are inversely associated with the presence of nonalcoholic fatty liver disease in patients with coronary artery disease[J]. Int J Clin Exp Med, 2015, 8(11): 21435-21441.
[10] LUO Y Q, MA X J, HAO Y P, et al. Inverse relationship between serum osteocalcin levels and nonalcoholic fatty liver disease in postmenopausal Chinese women with normal blood glucose levels[J]. Acta Pharmacol Sin, 2015, 36(12): 1497-1502. doi: 10.1038/aps.2015.81
[11] TAKASHI Y, KOGA M, MATSUZAWA Y, et al. Undercarboxylated osteocalcin can predict insulin secretion ability in type 2 diabetes[J]. J Diabetes Investig, 2017, 8(4): 471-474. doi: 10.1111/jdi.12601
[12] YANG Y P, ZHONG W X, HUANG J Y, et al. Association of serum osteocalcin levels with glucose metabolism in trauma patients[J]. Medicine, 2020, 99(36): e21901. doi: 10.1097/MD.0000000000021901
[13] BERGER M, ORTEGO A. Calculated decisions: injury severity score (ISS)[J]. Pediatr Emerg Med Pract, 2019, 16(5): CD1-CD2.
[14] BHADRICHA H, KHATKHATAY M I, DESAI M. Development of an in house ELISA for human intact osteocalcin and its utility in diagnosis and management of osteoporosis[J]. Clin Chim Acta, 2019, 489: 117-123. doi: 10.1016/j.cca.2018.12.007
[15] AGUSTINA H, ASYIFA I, AZIZ A, et al. The role of osteocalcin and alkaline phosphatase immunohistochemistry in osteosarcoma diagnosis[J]. Pathol Res Int, 2018, 2018: 6346409.
[16] LEE N K, SOWA H, HINOI E, et al. Endocrine regulation of energy metabolism by the skeleton[J]. Cell, 2007, 130(3): 456-469. doi: 10.1016/j.cell.2007.05.047
[17] GIUDICI K V, KINDLER J M, MARTIN B R, et al. Associations among osteocalcin, leptin and metabolic health in children ages 9-13 years in the United States[J]. Nutr Metab: Lond, 2017, 14: 25. doi: 10.1186/s12986-017-0171-9
[18] HU W W, KE Y H, HE J W, et al. Serum osteocalcin levels are inversely associated with plasma glucose and body mass index in healthy Chinese women[J]. Acta Pharmacol Sin, 2014, 35(12): 1521-1526. doi: 10.1038/aps.2014.92
[19] LI L, MESSINA J L. Acute insulin resistance following injury[J]. Trends Endocrinol Metab, 2009, 20(9): 429-435. doi: 10.1016/j.tem.2009.06.004
[20] PARKER L, LIN X, GARNHAM A, et al. Glucocorticoid-induced insulin resistance in men is associated with suppressed undercarboxylated osteocalcin[J]. J Bone Miner Res, 2019, 34(1): 49-58. doi: 10.1002/jbmr.3574
[21] BILOTTA F L, ARCIDIACONO B, MESSINEO S, et al. Insulin and osteocalcin: further evidence for a mutual cross-talk[J]. Endocrine, 2018, 59(3): 622-632. doi: 10.1007/s12020-017-1396-0
[22] LEVINGER I, JERUMS G, STEPTO N K, et al. The effect of acute exercise on undercarboxylated osteocalcin and insulin sensitivity in obese men[J]. J Bone Miner Res, 2014, 29(12): 2571-2576. doi: 10.1002/jbmr.2285
[23] STARUP-LINDE J, WESTBERG-RASMUSSEN S, LYKKEBOE S, et al. Glucose tolerance tests and osteocalcin responses in healthy people[J]. Front Endocrinol: Lausanne, 2018, 9: 356. doi: 10.3389/fendo.2018.00356
-
期刊类型引用(7)
1. 苏燕,徐九云,雷海露,刘晓蓓. 老年危重症患者发生再喂养综合征的危险因素回归方程的构建及干预措施分析. 实用临床医药杂志. 2024(01): 123-128 .  本站查看
本站查看
2. 谢婷,侯超,周旭辉,郭育君,练宇泽,曾亚琦. 经皮穴位电刺激在酒精依赖患者中的应用效果. 实用临床医药杂志. 2024(02): 38-42 .  本站查看
本站查看
3. 孙桂敏. 脑卒中伴吞咽障碍患者营养管理现况及研究进展. 医药前沿. 2024(24): 17-21 .  百度学术
百度学术
4. 王锦程,刘闯,周相宇,周素芳. 周素芳运用参苓白术散治疗酒精性肝病经验. 中医药通报. 2023(01): 12-14+67 .  百度学术
百度学术
5. 张兰,沈晓芳,金瑾,徐吉,张静. 无基础代谢性疾病急性缺血性卒中患者短期营养不良预测模型构建与验证. 中国卒中杂志. 2023(04): 428-433 .  百度学术
百度学术
6. 付志鹏,郑盛,杨涓. 肝硬化患者营养评价方法研究进展. 国际医药卫生导报. 2023(23): 3341-3344 .  百度学术
百度学术
7. 姚绍敏,王学义,余艳堂,雍恩华,宋志领. 早期营养支持对酒依赖患者临床结局的影响. 神经疾病与精神卫生. 2021(08): 557-561 .  百度学术
百度学术
其他类型引用(0)




 下载:
下载:
 苏公网安备 32100302010246号
苏公网安备 32100302010246号
