Differential expression and core genes mining of mitophagy-related genes in stomach adenocarcinoma
-
摘要:目的
探讨线粒体自噬相关基因(MRGs)在胃腺癌(STAD)中的差异表达并挖掘核心基因。
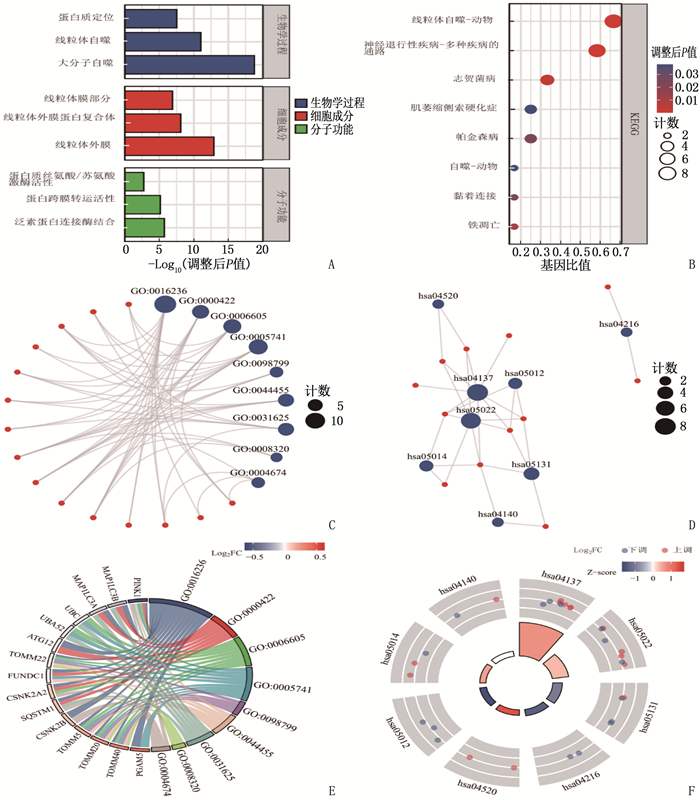
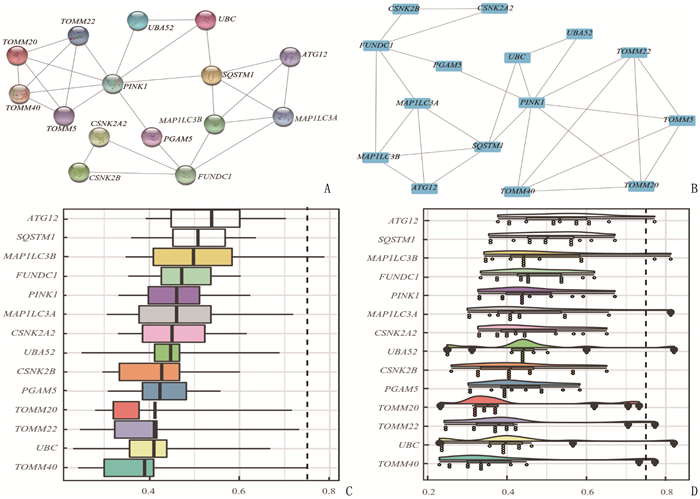
方法从基因表达综合数据库(GEO)和癌症基因组图谱(TCGA)数据库获得STAD患者的临床样本信息, 基于基因集富集分析(GSEA)网站和基因卡片(GeneCards)数据库获取有统计学意义的MRGs共26个; 基于最小绝对值收缩与选择算子(LASSO)回归构建MRGs在STAD中的预后模型,筛选出线粒体自噬预后相关基因(MPRGs)。通过基因本体论(GO)和京都基因与基因组百科全书(KEGG)富集分析,获得关键基因参与的生物学过程和通路; 利用STRING数据库构建MPRGs的蛋白质-蛋白质相互作用(PPI)网络,并应用Cytoscape软件进行可视化。
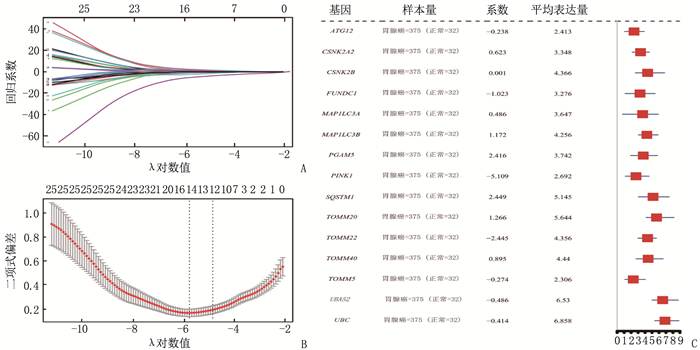
结果基于LASSO回归构建的预后模型中共筛选出15个MPRGs, 即ATG12、CSNK2A2、CSNK2B、FUNDC1、MAP1LC3A、MAP1LC3B、PGAM5、PINK1、SQSTM1、TOMM20、TOMM22、TOMM40、TOMM5、UBA52、UBC, 均为STAD的危险因素; 15个MPRGs中, UBC、UBA52基因对STAD的进展和预后影响更大, PGAM5表达与STAD的发生显著相关, ATG12基因与其他基因的功能相似性得分最高; PPI网络分析结果显示, PINK1蛋白与其他蛋白的相互作用最多。
结论15个MPRGs在STAD的发生与发展中起重要作用,或可作为STAD基因检测、治疗的靶点和STAD预后的独立预测工具。
Abstract:ObjectiveTo explore differential expression of mitophagy-related genes (MRGs) in stomach adenocarcinoma(STAD) and to investigate related core genes mining.
MethodsGene Expression Omnibus (GEO) and The Cancer Genome Atlas (TCGA) databases to obtain clinical sample information of patients with STAD. A total of 26 MRGs with statistical significance were obtained based on the Gene Set Enrichment Analysis (GSEA) website and GeneCards database. A prognostic model of MRGs in STAD was constructed based on Least Absolute Shrinkage and Selection Operator (LASSO) regression, and mitochondrial autophagy prognostic genes (MPRGs) were screened out. Through gene Ontology (GO) and Kyoto Encyclopedia of Genes and Genomes (KEGG) enrichment analysis, key genes involved in biological processes and pathways were obtained. Protein-protein interaction(PPI) network was established by means of STRING database, and the Cytoscape software was utilized for visualization.
ResultsFifteen MRGs were selected in the LASSO regression model: ATG12, CSNK2A2, CSNK2B, FUNDC1, MAP1LC3A, MAP1LC3B, PGAM5, PINK1, SQSTM1, TOMM20, TOMM22, TOMM40, TOMM5, UBA52 and UBC, which were risk factors for STAD. Among 15 MPRGs, UBC and UBA52 genes had more impact on progression and prognosis of STAD, and the expression of PGAM5 was significantly correlated with the occurrence of STAD. ATG12 gene had the highest functional similarity score with other genes. PPI network analysis showed that PINK1 protein had the most interactions with other proteins.
ConclusionA total of 15 MPRGs play important roles in the occurrence and development of STAD, and may be used as targets for STAD gene detection, treatment and independent prognostic tools for STAD.
-
直肠癌多数是由腺瘤性息肉演变而来,现代医学[1]认为多由环境、饮食、遗传等因素引发。中医认为直肠癌属“肠蕈”“肠中积聚”“脏毒”等范畴,主要以湿热、瘀毒蕴结于肠道,传导失司为基本病机[2]。据统计[3], 近年来中国直肠癌的发病率与病死率呈上升趋势,病死率居恶性肿瘤中第5位。中晚期直肠癌患者肿瘤侵犯较深且存在淋巴结、远处脏器转移,常以FOLFOX化疗为主,但单用化疗容易引起急性膀胱炎、骨髓抑制、放射性直肠炎、放射性皮炎等不良反应[4]。因此,如何提高化疗效果,且在化疗过程中减轻患者不适成为临床上的研究热点。艾愈胶囊是由山慈菇、白英、苦参、淫羊藿、人参、当归、白术制成的中成药。研究[5-7]证明,艾愈胶囊能够作为中晚期癌症的辅助治疗,临床上使用艾愈胶囊对乳腺癌、非小细胞肺癌及胃癌患者的临床疗效较好,但目前较少针对中晚期直肠癌患者的临床疗效、免疫治疗及生存期等方面进行研究。本研究在常规FOLFOX4化疗方案基础上增加艾愈胶囊治疗,观察对中晚期直肠癌患者疗效、细胞免疫功能以及生存期的影响。
1. 资料与方法
1.1 一般资料
选取2018年3月—2019年6月病理类型为腺癌的中晚期直肠癌患者360例为研究对象,治疗期间脱落13例,最终纳入347例。按照单双号法将其分为对照组173例与观察组174例。对照组男95例,女78例; TNM分期为Ⅲ期97例, Ⅳ期76例; 年龄56~80岁,平均年龄(62.78±3.64)岁。观察组男90例,女84例; TNM分期为Ⅲ期104例,Ⅳ期70例; 年龄56~80岁,平均年龄(63.11±3.26)岁。2组患者一般资料比较,差异无统计学意义(P>0.05)。本研究已获得医院医学伦理委员会批准(批号: 20180001)。诊断标准: ①符合《中国结直肠癌诊疗规范(2017年版)》[8]中关于结直肠癌的诊断标准者(首先,病史、体征、体格检查均符合直肠癌; 其次,经实验室检查、影像学检查及内镜检查确诊为中晚期直肠癌)。②中医诊断参考《中医肛肠科常见病诊疗指南-结直肠癌》标准[9], 均符合气血两虚型者(主证,面色苍白、气虚身重、口唇淡而不华; 次证,脱肛下坠、舌苔薄白、脉搏虚弱),患者具备上述任意1项主证、2项及以上次证即可确诊。纳入标准: ①年龄≥55岁者; ②符合中西医诊断标准者; ③签署知情同意书者; ④精神状态无异常可配合治疗者。排除标准: ①对本研究药物过敏者; ②重要脏器功能不全者; ③合并消化性溃疡、自身免疫系统疾病者; ④合并其他部位的恶性肿瘤者; ⑤预计存活时间<6个月者。
1.2 方法
对照组采用FOLFOX4化疗方案治疗。第1天静脉滴注奥沙利铂(购自山东新时代药业有限公司,规格50 mg, 国药准字H20133247)85 mg/m2, 亚叶酸钙(购自广东岭南制药有限公司,国药准字H20013091)200 mg/m2, 静脉推注氟尿嘧啶400 mg/m2后持续静脉滴注600 mg/m2; 第2天静脉滴注亚叶酸钙200 mg/m2, 静脉推注氟尿嘧啶400 mg/m2后持续静脉滴注600 mg/m2。每2周治疗1次, 1次为1个疗程,连续治疗4个疗程。观察组在对照组基础上口服艾愈胶囊(购自贵州益佰女子大药厂有限责任公司, 0.35 g/粒,国药准字Z20025336)治疗, 3粒/次, 3次/d, 2周为1个疗程,连续治疗4个疗程。
1.3 观察指标
临床疗效: 采用RECIST 1.1影像学评估肿瘤反应,以评估2组患者治疗2、4个疗程后的临床疗效。评估方法: 先向患者静脉中注射水溶性碘造影剂,使用电子计算机断层扫描仪[购于佳能医疗系统(中国)有限公司],并选择易于测量的靶病灶在动脉期计算每个病灶最长直径总和,比较目标病灶最长直径总和变化,并寻找是否出现新病灶,然后评判疗效。中医证候积分: 分别计算并比较2组患者治疗2、4个疗程后的中医症状积分。主症分别记0、2、4、6分,次症分别记0、1、2、3分。血清肿瘤标志物水平: 采集患者空腹静脉血5 mL, 3 500 r/min离心5 min后取上清液。采用全自动免疫分析仪(购于北京普朗医疗设备有限公司)检测血清中的癌胚抗原(CEA)与糖类抗原19-9(CA19-9)。细胞免疫功能测定: 采集患者空腹静脉血后,使用CytoFLEX流式细胞仪[购于贝克曼库尔特商贸(中国)有限公司]测定CD3+、CD4+、CD8+T细胞水平,并计算CD4+/CD8+值。记录治疗期间2组患者出现的不良反应,包括腹泻、骨髓抑制、皮炎、肝功能损害、肾功能损害。对所有患者随访36个月,比较2组累积存活率。
1.4 疗效标准
临床疗效: 完全缓解为动脉期未见目标病灶; 部分缓解为在动脉期目标病灶直径总和缩小≥30%; 病情稳定为动脉期目标病灶直径缩小<30%或动脉期目标病灶直径未见扩大; 疾病进展为目标病灶动脉期直径总和增大或出现了新病灶。疾病控制率=(完全缓解例数+部分缓解例数+病情稳定例数)/总例数×100%。中医证候积分: 记录并比较2组治疗前以及治疗2、4个疗程后主症、次症积分及总积分。
1.5 统计学处理
本研究所用数据均使用SPSS 24.0进行统计分析。变量资料采用($\overline x $ ±s)表示,行t检验; 不同组间、不同时点及交互作用采用方差分析,计数资料以[n(%)]表示,行χ2检验, P<0.05表示差异有统计学意义。绘制36个月的中晚期直肠癌患者Kaplan-Meier曲线,并使用Log-rank检验计算P值。
2. 结果
2.1 2组临床疗效比较
治疗2个疗程后,观察组完全缓解率高于对照组,差异有统计学意义(P<0.05); 观察组疾病控制率高于对照组,差异有统计学意义(P<0.05)。治疗4个疗程后,观察组完全缓解率高于对照组,差异有统计学意义(P<0.05); 对照组、观察组疾病控制率比较,差异无统计学意义(P>0.05), 见表 1。
表 1 2组治疗后临床疗效比较[n(%)]时点 组别 n 完全缓解 部分缓解 病情稳定 疾病进展 疾病控制 治疗2个疗程后 对照组 173 7(4.05) 85(49.13) 72(41.62) 9(5.20) 164(94.80) 观察组 174 28(16.09)* 94(54.02) 52(29.89)* 0* 174(100.00)* 治疗4个疗程后 对照组 173 14(8.09) 89(51.45) 67(38.73) 3(1.73) 170(98.27) 观察组 174 36(20.69)* 99(56.90) 39(22.41)* 0 174(100.00) 与对照组比较, * P<0.05。 2.2 2组治疗前后中医证候积分比较
治疗后, 2组主症、次症积分及总积分均降低,且观察组低于对照组,差异有统计学意义(P<0.05), 见表 2。
表 2 2组治疗前后中医证候积分比较($\overline x $ ±s)分 时点 组别 n 主症积分 次症积分 总积分 治疗前 对照组 173 16.49±3.07 5.66±1.62 22.15±5.32 观察组 174 16.34±3.16 5.71±1.58 22.05±4.74 治疗2个疗程后 对照组 173 11.37±2.59* 4.97±1.21* 16.34±3.80* 观察组 174 9.46±2.48*△ 4.25±1.07*△ 13.71±3.55*△ 治疗4个疗程后 对照组 173 7.94±2.01*# 2.84±1.16*# 10.78±3.17*# 观察组 174 5.68±1.46*#△ 1.95±0.73*#△ 7.63±2.92*#△ 与治疗前比较, * P<0.05; 与治疗2个疗程后比较, #P<0.05; 与对照组比较, △P<0.05。 2.3 2组治疗前后血清肿瘤标志物水平比较
治疗2个疗程后, 2组患者CEA、CA19-9水平较治疗前降低,且观察组低于对照组,差异有统计学意义(P<0.05); 治疗4个疗程后, 2组患者CEA、CA19-9水平较治疗前和治疗2个疗程后降低,且观察组低于对照组,差异有统计学意义(P<0.05), 见表 3。
表 3 2组治疗前后血清肿瘤标志物水平比较($\overline x $ ±s)时点 组别 n 癌胚抗原/(ng/mL) 糖类抗原19-9/(U/mL) 治疗前 对照组 173 19.88±5.23 46.78±11.25 观察组 174 19.67±5.33 47.04±11.23 治疗2个疗程后 对照组 173 18.72±5.21* 42.16±10.78* 观察组 174 16.22±4.48*△ 38.44±8.22*△ 治疗4个疗程后 对照组 173 16.73±5.32*# 38.99±9.56*# 观察组 174 14.26±3.88*#△ 34.22±7.35*#△ 与治疗前比较, * P<0.05; 与治疗2个疗程后比较, #P<0.05; 与对照组比较, △P<0.05。 2.4 2组治疗前后细胞免疫功能比较
治疗2个疗程后,对照组CD3+、CD4+、CD8+ T细胞水平及CD4+/CD8+与治疗前比较,差异无统计学意义(P>0.05); 治疗2个疗程后,观察组CD3+、CD4+ T细胞水平和CD4+/CD8+较治疗前均增高, CD8+ T细胞水平较治疗前降低,差异有统计学意义(P<0.05)。治疗4个疗程后,对照组CD3+ T细胞水平与治疗前比较,差异无统计学意义(P>0.05); 对照组CD8+ T细胞水平较治疗前降低, CD4+ T细胞水平和CD4+/CD8+较治疗前均增高,差异有统计学意义(P<0.05); 对照组CD3+、CD8+ T细胞水平与治疗2个疗程后比较,差异无统计学意义(P>0.05); 对照组CD4+ T细胞水平和CD4+/CD8+较治疗2个疗程后均增高,差异有统计学意义(P<0.05)。治疗4个疗程后,观察组CD3+、CD4+ T细胞水平和CD4+/CD8+较治疗前均增高, CD8+T细胞水平较治疗前降低,差异有统计学意义(P<0.05); CD3+、CD4+、CD8+ T细胞水平及CD4+/CD8+与治疗2个疗程后比较,差异均无统计学意义(P>0.05), 见表 4。
表 4 2组治疗前后细胞免疫功能比较($\overline x $ ±s)时点 组别 n CD3+/% CD4+/% CD8+/% CD4+/CD8+ 治疗前 对照组 173 54.26±4.32 32.28±3.29 26.88±3.17 1.20±0.22 观察组 174 54.34±4.29 32.31±3.18 26.67±3.27 1.21±0.24 治疗2个疗程后 对照组 173 53.72±4.05 32.75±3.74 25.46±2.78 1.28±0.25 观察组 174 55.49±5.21* 35.64±3.62* 23.16±2.54* 1.54±0.27* 治疗4个疗程后 对照组 173 54.45±5.01 34.55±3.82*# 24.67±2.59* 1.40±0.21*# 观察组 174 56.73±4.48* 36.87±4.01* 23.01±1.57* 1.60±0.25* 与治疗前比较, * P<0.05; 与治疗2个疗程后比较, #P<0.05。 2.5 2组治疗期间不良反应情况比较
治疗期间,观察组皮炎发生率和肝功能损害发生率低于对照组,差异有统计学意义(P<0.05); 2组其他不良反应发生率比较,差异无统计学意义(P>0.05), 见表 5。
表 5 2组治疗期间不良反应情况比较[n(%)]组别 n 腹泻 骨髓抑制 皮炎 肝功能损害 肾功能损害 对照组 173 31(17.92) 33(19.08) 33(19.08) 25(14.45) 11(6.36) 观察组 174 25(14.37) 31(17.82) 11(6.32)* 6(3.45)* 6(3.45) 与对照组比较, *P<0.05。 2.6 2组患者累积存活率比较
随访36个月后,对照组、观察组存活患者分别为36、69例,生存率分别为20.81%、39.66%。K-M生存曲线显示,观察组累积存活率高于对照组,差异有统计学意义(Log-rank χ2=6.434, P=0.011), 见图 1。
3. 讨论
直肠癌是由环境、个人生活习惯及家族史等多种因素共同作用所致。疾病早期通常无症状,后期则可能出现大便性状改变、排便习惯改变等症状。随着环境质量、饮食习惯及生活习惯的改变,直肠癌的发病率和致死率逐年攀升,对患者的生命安全构成了严重威胁[10]。中医学将直肠癌归为“症瘕”“肠覃”“肠风”等范畴,认为外感邪湿、饮食不洁、情志所伤导致肝气郁结、正气亏虚是其主要病机[11]。目前,中晚期直肠癌常以化疗控制疾病进展为主[12-14]。然而,单独实施化疗存在预后不佳、免疫功能受损、生存期缩短及不良反应明显等缺点[15-16]。因此,探索有效抑制肿瘤细胞生长、提高中晚期直肠癌患者临床疗效的治疗方式成为临床研究重点。近年来,中药在癌症治疗中的应用价值日益凸显,但具体药物选择尚存争议。艾愈胶囊已被研究证实适用于中晚期癌症的辅助治疗,其成分包括山慈菇、淫羊藿、苦参、白英、当归、人参、白术等。FOLFOX4化疗方案作为直肠癌治疗的常用方案,联合应用5-氟尿嘧啶、奥沙利铂和亚叶酸钙能够有效抑制肿瘤细胞生长与转移[17]。本研究在FOLFOX4化疗方案基础上,加入艾愈胶囊治疗中晚期直肠癌患者,旨在观察临床疗效,为中晚期结直肠癌患者的临床治疗提供科学依据与参考。
本研究结果显示,观察组完全缓解率高于对照组,主症、次症及总积分均低于对照组,表明艾愈胶囊联合FOLFOX4化疗方案在治疗中晚期直肠癌患者中展现出更佳的临床疗效,可能归因于中医对直肠癌的治疗更侧重补气、补血及解毒散结。山慈菇具有清热解毒、消肿散结的功效[18]; 淫羊藿补肾壮阳; 苦参清热凉血、解毒,并能祛除表里、经络、脏腑间的风邪[19]; 白英利湿消肿、清热解毒,具有抗癌能力[20]; 白术健脾益气、利水渗湿[21]; 当归活血行血、顺气导滞[22]; 人参复脉固脱、生津养血、补脾益气[23]。因此,药物协同作用,共同实现了补气、补血、解毒散结的治疗效果,与FOLFOX4化疗方案联合应用,显著提高了直肠癌中晚期患者的临床疗效。
本研究进一步分析了肿瘤标志物水平与淋巴细胞数量的变化,结果显示,观察组治疗后CEA、CA19-9水平降低, CD8+ T细胞水平下降,而CD3+、CD4+ T细胞水平及CD4+/CD8+上升,表明艾愈胶囊联合FOLFOX4化疗方案在降低肿瘤标志物水平的同时,能有效增强患者细胞免疫功能,与相关研究[24]结果相吻合。CEA作为临床常用的肿瘤标志物,其高水平常提示消化道癌症的存在; CA19-9作为消化道肿瘤的典型标志物,对直肠癌具有较高的敏感性[25]。T淋巴细胞在调节机体免疫系统功能中起关键作用,其功能状态由CD3+、CD4+、CD8+组成决定。当CD3+、CD4+ T细胞水平及CD4+/CD8+下降, CD8+ T细胞水平上升时,提示机体免疫功能受到抑制[26]。研究[27-28]已证实,山慈菇中的菲类化合物、苦参及其氧化产物能抑制肿瘤细胞生长; 白英的水提取物可抑制直肠癌细胞生长; 白术提取物则通过诱导肿瘤细胞凋亡来抑制其增殖,发挥抗肿瘤作用。这些成分有效降低了CEA、CA19-9水平,共同发挥了抗肿瘤功效。此外,淫羊藿中的活性成分通过调控癌症相关途径及多个信号通路,增强机体免疫功能[29]。小鼠试验[30]表明,苦参多糖提取物能促进小鼠淋巴细胞增殖,提升免疫功能; 当归、白术则能促进T淋巴细胞和B淋巴细胞的增殖,有效改善免疫功能[31]。因此,艾愈胶囊通过提高CD3+、CD4+ T细胞水平及CD4+/CD8+、降低CD8+ T细胞水平改善患者机体免疫功能。
中晚期直肠癌患者常采用化学治疗,但化疗药物在杀伤肿瘤细胞的同时,也会对正常细胞造成损伤,从而引发腹泻、呕吐、骨髓抑制及皮肤异常等多种不良反应,严重时甚至影响患者耐受性,并对患者生存期产生不利影响[32]。本研究发现,观察组不良反应发生率低于对照组,特别是在肝功能损害及皮炎方面[33], 可能归因于白英中富含苷类、有机酸类、香豆素等多种化合物,具有良好的护肝作用[34]; 当归化学提取物具有祛风止痒、抑制皮炎发生的效果[35-36]。艾愈胶囊联合FOLFOX4化疗方案相较于单独化疗,能显著降低不良反应发生率。此外,本研究还显示,观察组累积存活率高于对照组,表明艾愈胶囊联合FOLFOX4化疗方案能有效抑制肿瘤进展,延长患者生存期,从而改善中晚期结直肠癌患者的临床预后。
但本研究仍存在一定局限性,可能导致研究结果出现偏倚。首先,本研究仅从免疫调节角度探讨治疗方案的临床疗效,未从动物或细胞模型方面探讨其潜在机制。其次,为保证用药安全,未对患者更改药物剂量以及疗程。最后,本研究直肠癌中腺癌患者占比较高,其他病理类型较少。未来需要进一步研究对本研究结果进行验证。
综上所述,艾愈胶囊联合FOLFOX4化疗方案能够促进中晚期直肠癌患者免疫功能恢复,缓解化疗不良反应,延长患者生存期,提高临床化疗疗效。
-
表 1 26个线粒体自噬相关基因列表
基因名称 基因中文译名 基因名称 基因中文译名 ATG5 自噬相关5同源物 SQSTM1 死骨片1 FUNDC1 含FUN14域1 UBB 泛素B CSNK2A2 酪蛋白激2 α2原肽 MFN1 丝裂融蛋白1 TOMM22 线粒体外膜转位酶22 TOMM20 线粒体外膜转位酶20 CSNK2A1 酪蛋白激酶2α1肽 TOMM5 线粒体外膜转位酶5 MAP1LC3A 微管关联蛋白1轻链3α ULK1 unc-51样激酶1 MFN2 丝裂融蛋白2 TOMM7 线粒体外膜转位酶7 TOMM40 线粒体外膜转位酶40 SRC 肉瘤病毒癌基因同源物 MAP1LC3B 微管关联蛋白1轻链3β CSNK2B 酪蛋白激酶2β肽 RPS27A 核糖体蛋白S27a VDAC1 电压依赖阴离子通道1 ATG12 自噬相关12同源物 TOMM6 线粒体外膜转位酶6 UBC 泛素C UBA52 泛素A-52 PINK1 PTEN引导预测激酶1 PGAM5 磷酸甘油酸变旋酶家族成员5 表 2 线粒体自噬预后相关基因的差异表达情况分析
基因名称 中文译名 log2FC P P.adj ATG12 自噬相关12同源物 -0.025 0.510 0.626 CSNK2A2 酪蛋白激酶2 α1肽 0.080 0.024 0.054 CSNK2B 酪蛋白激酶2 β肽 0.115 0.055 0.107 FUNDC1 含FUN14域1 0.011 0.867 0.915 MAP1LC3A 微管关联蛋白1轻链3α -0.100 0.273 0.391 MAP1LC3B 微管关联蛋白1轻链3β -0.151 0.001 0.005 PGAM5 磷酸甘油酸变旋酶家族成员5 0.430 < 0.001 < 0.001 PINK1 PTEN引导预测激酶1 -0.632 < 0.001 < 0.001 SQSTM1 死骨片1 0.115 0.073 0.136 TOMM20 线粒体外膜转位酶20 0.265 < 0.001 < 0.001 TOMM22 线粒体外膜转位酶22 -0.023 0.635 0.735 TOMM40 线粒体外膜转位酶40 0.328 < 0.001 < 0.001 TOMM5 线粒体外膜转位酶5 0.195 < 0.001 0.001 UBA52 泛素A-52 -0.039 0.435 0.554 UBC 泛素C -0.046 0.330 0.450 表 3 线粒体自噬预后相关基因的GO富集分析结果
类别 基因编码 描述 基因比值 背景比值 P P.adj q 生物学过程 GO: 0016236 大分子自噬 13/15 295/18 670 < 0.001 < 0.001 < 0.001 生物学过程 GO: 0000422 线粒体自噬 7/15 76/18 670 < 0.001 < 0.001 < 0.001 生物学过程 GO: 0006605 蛋白质定位 8/15 432/18 670 < 0.001 < 0.001 < 0.001 细胞成分 GO: 0005741 线粒体外膜 9/15 178/19 717 < 0.001 < 0.001 < 0.001 细胞成分 GO: 0098799 线粒体外膜蛋白复合体 4/15 16/19 717 < 0.001 < 0.001 < 0.001 细胞成分 GO: 0044455 线粒体膜部分 6/15 229/19 717 < 0.001 < 0.001 < 0.001 分子功能 GO: 0031625 泛素蛋白连接酶结合 6/14 290/17 697 < 0.001 < 0.001 < 0.001 分子功能 GO: 0008320 蛋白跨膜转运活性 3/14 20/17 697 < 0.001 < 0.001 < 0.001 分子功能 GO: 0004674 蛋白质丝氨酸/苏氨酸激酶活性 4/14 439/17 697 < 0.001 0.002 0.001 GO: 基因本体论; 基因比值: 目标基因富集到目的通路的基因个数占目标基因总数(包含基因集总基因)的比值; 背景比值: 参与该代谢通路的基因数与整个基因组中相关基因数的比值; q: 检测阳性个体中,假阳性个体所占比值。 表 4 线粒体自噬预后相关基因的KEGG通路富集分析结果
编码 描述 基因比值 背景比值 P P.adj q hsa04137 线粒体自噬-动物 8/12 68/8 076 < 0.001 < 0.001 < 0.001 hsa05022 神经退行性疾病-多种疾病的通路 7/12 475/8 076 < 0.001 < 0.001 < 0.001 hsa05131 志贺菌病 4/12 246/8 076 < 0.001 0.003 0.001 hsa04216 铁凋亡 2/12 41/8 076 0.002 0.011 0.005 hsa04520 黏着连接 2/12 71/8 076 0.005 0.024 0.010 hsa05012 帕金森病 3/12 249/8 076 0.005 0.024 0.010 hsa05014 肌萎缩侧索硬化症 3/12 364/8 076 0.015 0.038 0.016 hsa04140 自噬-动物 2/12 137/8 076 0.017 0.038 0.016 KEGG: 京都基因与基因组百科全书。 -
[1] SHAFABAKHSH R, YOUSEFI B, ASEMI Z, et al. Chitosan: a compound for drug delivery system in gastric cancer-a review[J]. Carbohydr Polym, 2020, 242: 116403. doi: 10.1016/j.carbpol.2020.116403
[2] 钱慧琴. 基于网络药理学探讨肿节风治疗胃癌的作用机制[J]. 沈阳药科大学学报, 2022, 39(8): 979-987. https://www.cnki.com.cn/Article/CJFDTOTAL-SYYD202208012.htm [3] AVENTAGGIATO M, VERNUCCI E, BARRECA F, et al. Sirtuins' control of autophagy and mitophagy in cancer[J]. Pharmacol Ther, 2021, 221: 107748. doi: 10.1016/j.pharmthera.2020.107748
[4] 李祎龙, 雷凯, 张小昭, 等. 1, 25-二羟维生素D3对人结肠癌细胞凋亡和自噬的影响及机制研究[J]. 实用临床医药杂志, 2021, 25(13): 5-9. doi: 10.7619/jcmp.20211388 [5] FERRO F, SERVAIS S, BESSON P, et al. Autophagy and mitophagy in cancer metabolic remodelling[J]. Semin Cell Dev Biol, 2020, 98: 129-138. doi: 10.1016/j.semcdb.2019.05.029
[6] 张标. TP53突变在肝细胞癌中的意义[D]. 大连: 大连医科大学, 2022. [7] YUAN Q H, DENG D W, PAN C, et al. Integration of transcriptomics, proteomics, and metabolomics data to reveal HER2-associated metabolic heterogeneity in gastric cancer with response to immunotherapy and neoadjuvant chemotherapy[J]. Front Immunol, 2022, 13: 951137. doi: 10.3389/fimmu.2022.951137
[8] GOLDMAN M J, CRAFT B, HASTIE M, et al. Visualizing and interpreting cancer genomics data via the Xena platform[J]. Nat Biotechnol, 2020, 38(6): 675-678. doi: 10.1038/s41587-020-0546-8
[9] 张良舜, 叶桦. 基于GEO胃癌芯片数据的生物信息学分析[J]. 现代实用医学, 2022, 34(11): 1409-1411, F0002. doi: 10.3969/j.issn.1671-0800.2022.11.004 [10] 唐焘, 武敏, 王君, 等. C型尼曼-匹克蛋白2在胃癌组织中的表达及其功能初步研究[J]. 第三军医大学学报, 2021, 43(21): 2381-2388. https://www.cnki.com.cn/Article/CJFDTOTAL-DSDX202121017.htm [11] 蒿花, 田国祥, 耿辉, 等. 人类基因综合分析数据库GeneCards的应用介绍[J]. 中国循证心血管医学杂志, 2021, 13(8): 902-906. doi: 10.3969/j.issn.1674-4055.2021.08.03 [12] 葛继芸, 姚晨, 张菁, 等. CALB2介导的肿瘤微环境免疫细胞浸润在肝癌复发中的作用机制分析[J]. 海军军医大学学报, 2022, 43(7): 744-751. https://www.cnki.com.cn/Article/CJFDTOTAL-DEJD202207004.htm [13] 桑珍珍, 杨栋梁, 饶欣, 等. 基于加权基因共表达网络分析探讨新型冠状病毒感染相关脓毒症潜在的关键基因[J]. 中国急救医学, 2023, 43(5): 376-382. https://www.cnki.com.cn/Article/CJFDTOTAL-ZJJY202305007.htm [14] 何融泉. 大数据先验模式构建膀胱癌非编码RNA全景图谱及SCARNA12的分子机制研究[D]. 南宁: 广西医科大学, 2019. [15] 吴茜, 宋兴勃, 钟慧钰, 等. 胃癌关键基因和通路的生物信息学和功能分析[J]. 肿瘤预防与治疗, 2020, 33(2): 131-139. https://www.cnki.com.cn/Article/CJFDTOTAL-SCZF202002009.htm [16] 姚志强. 基于生物信息学鉴定CTSV作为膀胱癌诊断和预后的标志物及预后nomogram的构建[D]. 兰州: 兰州大学, 2021. [17] 罗倩, 詹雪冰, 董芳媛, 等. 基于数据库分析CDCA基因家族在胃癌中的表达及预后意义[J]. 包头医学院学报, 2021, 37(11): 45-50. https://www.cnki.com.cn/Article/CJFDTOTAL-BTYX202111011.htm [18] 张颖, 邱汉波, 侯恩存, 等. 基于网络药理学-分子对接研究益气逐淤汤针对胃癌的作用机制[J]. 世界中医药, 2021, 16(23): 3484-3490. https://www.cnki.com.cn/Article/CJFDTOTAL-SJZA202123014.htm [19] NIE Y L, LIANG X J, LIU S H, et al. WASF3 knockdown sensitizes gastric cancer cells to oxaliplatin by inhibiting ATG12-mediated autophagy[J]. Am J Med Sci, 2020, 359(5): 287-295.
[20] MENG L, HU P B, XU A M. PGAM5 promotes tumorigenesis of gastric cancer cells through PI3K/AKT pathway[J]. Pathol Res Pract, 2023, 244: 154405.
[21] 张浩, 张悦, 赵文武, 等. PINK1/Parkin介导的线粒体自噬及其在肝脏疾病发生发展中的作用机制[J]. 临床肝胆病杂志, 2020, 36(7): 1663-1665. https://www.cnki.com.cn/Article/CJFDTOTAL-LCGD202007057.htm [22] 肖依依. 二甲双胍通过激活AMPKα诱导PINK1/Parkin介导的线粒体自噬降低胃癌细胞顺铂化疗敏感性的研究[D]. 南昌: 南昌大学, 2022. [23] SALAZAR C, RUIZ-HINCAPIE P, RUIZ L. The interplay among PINK1/PARKIN/dj-1 network during mitochondrial quality control in cancer biology: protein interaction analysis[J]. Cells, 2018, 7(10): 154.
[24] MIYAZAKI N, SHIRATORI R, OSHIMA T, et al. PINK1-dependent and Parkin-independent mitophagy is involved in reprogramming of glycometabolism in pancreatic cancer cells[J]. Biochem Biophys Res Commun, 2022, 625: 167-173.
[25] 李娜, 王培红, 李俊杰, 等. MIF通过调节急性幽门螺杆菌感染介导的炎症反应、自噬和凋亡促进胃癌细胞增殖及细胞周期进展[J]. 中国免疫学杂志, 2023, 39(2): 336-342. https://www.cnki.com.cn/Article/CJFDTOTAL-ZMXZ202302019.htm




 下载:
下载:

 苏公网安备 32100302010246号
苏公网安备 32100302010246号
