Risk factor analysis and personalized prevention strategies for renal anemia in hemodialysis patients with end-stage kidney disease
-
摘要:目的
探讨终末期肾脏病(ESKD)血液透析患者肾性贫血的危险因素。
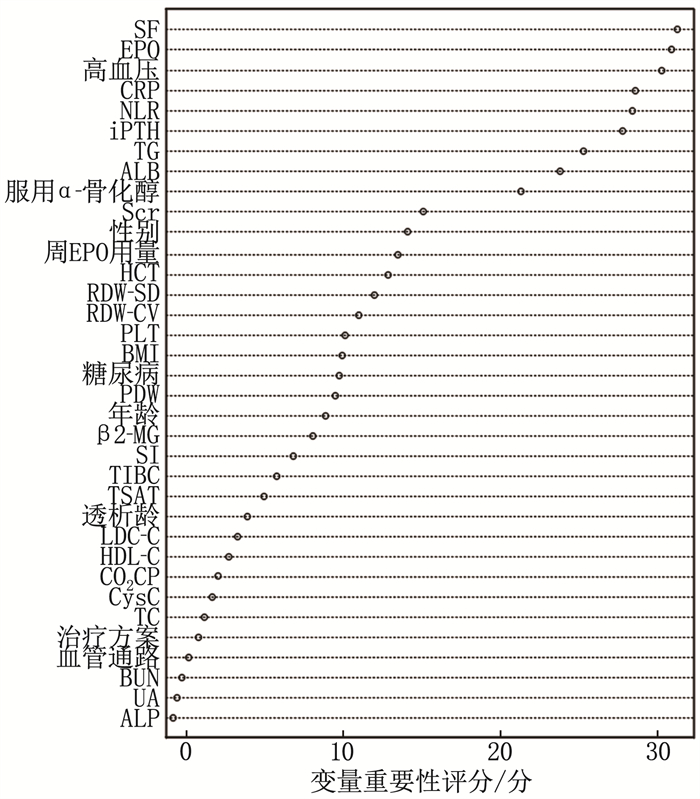
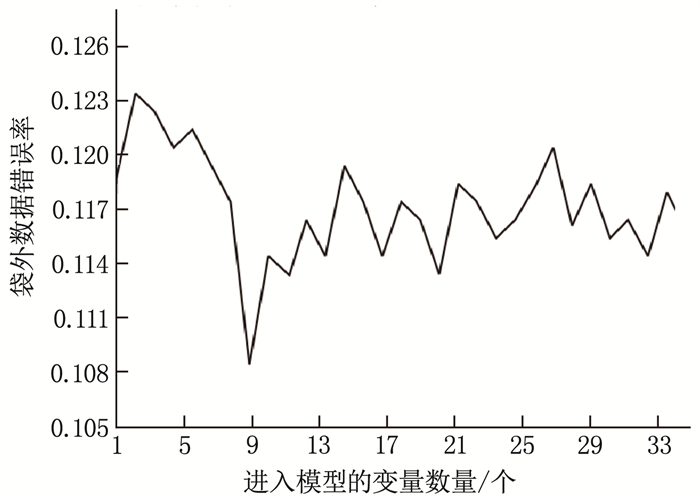
方法回顾性选取2021年12月—2022年12月于本院行血液透析治疗的148例ESKD患者作为研究对象, 根据血红蛋白(Hb)水平的不同及肾性贫血诊断标准将患者分为肾性贫血组(86例)和非贫血组(62例)。比较2组临床资料。采用随机森林算法及多因素Logistic回归分析筛选影响肾性贫血的因素,并建立多因素Logistic回归模型,同时采用十字交叉试验验证模型的稳定性。建立风险分层系统,并根据X-Tile软件获得的截断值对患者进行风险分层。采用受试者工作特征(ROC)曲线评价多因素Logistic回归模型和风险分层系统的区分度。
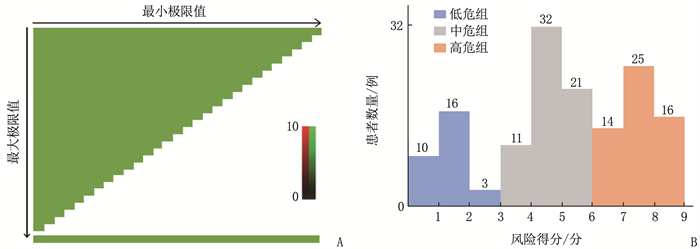
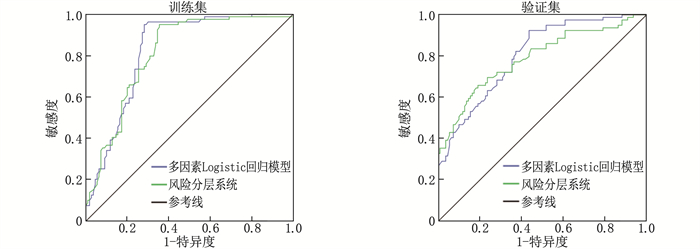
结果148例ESKD患者中,肾性贫血发生率为58.11%(86/148); 高血压、中性粒细胞与淋巴细胞比值(NLR)增加、C反应蛋白(CRP)升高、血清铁蛋白(SF)升高、全段甲状旁腺激素(iPTH)升高是影响患者肾性贫血发生的危险因素(P < 0.05), 服用α-骨化醇、促红细胞生成素(EPO)升高、甘油三酯(TG)升高、血清白蛋白(ALB)升高是保护因素(P < 0.05)。多因素Logistic回归模型的拟合优度检验结果显示Nagelkerke R2=0.593。根据X-Tile软件获得风险评分的截断值,将患者分为低危组(< 4分, 29例)、中危组(4~ < 7分, 64例)和高危组(≥7分, 55例), 肾性贫血发生率分别为24.14%、57.81%和76.36%。3组肾性贫血发生率比较,差异有统计学意义(P < 0.001)。训练集中多因素Logistic回归模型和风险分层系统的ROC曲线的曲线下面积分别为0.826、0.811, 验证集中分别为0.804和0.789。
结论ESKD血液透析患者肾性贫血的发生受高血压、NLR、CRP等诸多因素的影响。
Abstract:ObjectiveTo explore the risk factors for renal anemia in hemodialysis patients with end-stage kidney disease (ESKD).
MethodsA total of 48 ESKD patients undergoing hemodialysis in our hospital from December 2021 to December 2022 were selected as study objects. They were divided into renal anemia group (86 cases) and non-anemia group (62 cases) based on hemoglobin (Hb) levels and diagnostic criteria for renal anemia. Clinical data between the two groups were compared. Random forest algorithm and multivariate Logistic regression analysis were used to screen for factors influencing renal anemia, and a multivariate Logistic regression model was established. Cross-validation was also employed to verify the stability of the model. A risk stratification system was developed, and patients were stratified based on cut-off values obtained from X-Tile software. The areas under the receiver operating characteristic (ROC) curves were used to evaluate the discrimination ability of the multivariate Logistic regression model and the risk stratification system.
ResultsAmong 148 ESKD patients, the incidence of renal anemia was 58.11% (86/148). Hypertension, increased neutrophil-to-lymphocyte ratio (NLR), elevated C-reactive protein (CRP), increased serum ferritin (SF), and elevated intact parathyroid hormone (iPTH) were identified as risk factors for renal anemia (P < 0.05). Administration of α-calcidol, increased erythropoietin (EPO), elevated triglyceride (TG), and increased serum albumin (ALB) were protective factors (P < 0.05). The goodness-of-fit test for the multivariate Logistic regression model showed a Nagelkerke R2 of 0.593. Based on the cut-off values for risk scores obtained from X-Tile software, patients were stratified into low-risk group (< 4 points, 29 cases), medium-risk group (4 to < 7 points, 64 cases), and high-risk group (≥7 points, 55 cases), with renal anemia incidence rates of 24.14%, 57.81%, and 76.36%, respectively. The difference in renal anemia incidence rates among the three groups was statistically significant (P < 0.001). In the training set, the areas under the ROC curves for the multivariate Logistic regression model and the risk stratification system were 0.826 and 0.811, respectively, and were 0.804 and 0.789, respectively in the validation set.
ConclusionThe occurrence of renal anemia in hemodialysis patients with ESKD is influenced by various factors, including hypertension, NLR, CRP, etc.
-
神经母细胞瘤(NB)是儿童最常见的颅外实体肿瘤,占所有儿童新发肿瘤的8%~10%, 致死例数占儿童肿瘤死亡人数的15%[1]。NB起源于胚胎的交感神经节或肾上腺髓质,好发于肾上腺以及颈、胸、腹部、盆腔的交感肾上腺轴部位,最显著的特征是肿瘤的高度异质性[2]。NB既可表现为自发消退并向良性转化的局部肿瘤,也可表现为对强化治疗耐药并具有侵袭性的高度恶性肿瘤,大多数需要积极治疗干预。即使采用包括手术、化疗、放射治疗(简称放疗)、骨髓移植和免疫治疗在内的综合干预措施,高危NB患儿的总体预后仍不理想。国内研究[3]报道,目前高危NB患儿的5年生存率仍低于50%。术后残留肿瘤床的局部复发是NB患儿预后不良的重要原因[4]。虽然放疗能够有效抑制肿瘤的局部复发[5], 但大剂量放疗有多种副作用,会影响NB患儿的预后。相关研究[6]认为,放疗对降低NB复发率和提升NB患者生存率的影响仍不确定,尚需进一步研究。本研究收集100例高危NB患儿的临床资料进行分析,旨在探讨放疗对高危NB患儿预后的影响,为高危NB的临床治疗提供参考依据。
1. 资料与方法
1.1 一般资料
回顾性分析2018年1月—2022年12月苏州大学附属儿童医院普外科收治的100例高危NB患儿的临床资料,包括年龄、性别、肿瘤原发部位、血清神经元特异性烯醇化酶(NSE)、MYCN基因扩增情况, 24 h尿香草扁桃酸(VMA)水平、是否接受放疗、肿瘤复发和转移情况等。100例NB患儿均经病理组织学或骨髓细胞学检查确诊,并根据年龄、MYCN扩增情况、肿瘤分期和病理类型判定为高危患儿。排除标准: ①合并心、肺、肝、肾等重要脏器功能明显受损者; ②合并难以控制的全身感染或脓毒血症者; ③合并严重贫血、消瘦或处于恶病质状态的终末期患者; ④不接受随访或短期内失访者。本研究经过苏州大学附属儿童医院伦理委员会审核批准,所有患儿家属均签署知情同意书。
100例NB患儿中,男56例,女44例; 年龄3~66个月,平均(23.20±19.96)个月,年龄 < 18个月者40例, ≥18个月者60例; 肿瘤原发于肾上腺及腹膜后66例,其他部位(纵隔、颈部及多体腔累及)34例; NB远处转移56例,其中骨转移16例、骨髓转移24例、肝脏转移8例、颅脑转移8例; MYCN基因扩增40例,无MYCN基因扩增60例; 24 h尿VMA < 13.6 mg者54例, ≥ 13.6 mg者46例; 血清NSE < 100μg/L者52例, ≥100 μg/L者48例。根据是否接受放疗,将100例患儿分为放疗组58例和未放疗组42例。
1.2 治疗方案
高危NB的治疗方案一般分为诱导期方案(化疗和手术)、巩固期方案(自体外周血造血干细胞移植及放疗)和维持治疗期方案(免疫治疗联合13-顺式维甲酸治疗)。化疗方案: 根据《儿童神经母细胞瘤诊疗专家共识CCCG-NB-2021方案》[7]中的原则制订。放疗适应证: 年龄≥18个月的高危NB患儿,若全身情况能够耐受放疗,均需接受放疗; 年龄 < 18个月的高危NB患儿,若肿瘤原发灶短期内增大而影响重要脏器功能或转移灶引起明显症状,例如眼眶部位肿瘤压迫造成视力受损、骨转移引起肢体剧烈疼痛等[8], 也应接受放疗。放疗靶区: 原发部位术后的残留肿瘤床、区域淋巴结和远处转移灶。一般情况下,放疗剂量为21.6 Gy, 分14次(2次/d)或12次(1次/d) 完成; 对于NB肿瘤残留者,局部放疗剂量可增加为30~36 Gy。对于复发患儿,根据具体情况实施个体化挽救性治疗。
1.3 临床分期和危险度分级
参照国际神经母细胞瘤分期系统(INSS),肿瘤分期分为Ⅰ期、Ⅱa期、Ⅱb期、Ⅲ期、Ⅳ期和Ⅳs期[9]。根据年龄、MYCN基因扩增情况、肿瘤分期和病理类型,危险度分为高危、中危、低危。本研究中, 100例NB患儿的肿瘤分期为Ⅲ~Ⅳ期,危险度分级为高危。
1.4 随访
随访截至2022年12月或患儿死亡、失访,终点事件为复发或死亡,最长随访时间30个月。随访方式为门诊复诊、微信随访或电话随访,随访内容包括是否肿瘤复发、是否死亡、有无远处转移、相关实验室检查及影像学检查结果。
1.5 疗效评估
无复发生存期指确诊至肿瘤复发的时间,总生存期指确诊至全因死亡的时间。
1.6 统计学分析
无复发生存率和总生存率按照确诊至复发或死亡的时间计算,或按照确诊至末次随访的时间计算。采用SPSS 25.0软件进行统计学分析,样本量n≥40时, T≥5使用卡方检验,任意单元格中T>1~ < 5时,使用连续校正卡方检验。使用Kaplan-Meier法进行生存分析,生存率比较采用Log-rank检验, P < 0.05为差异有统计学意义。
2. 结果
2.1 NB患儿肿瘤复发的单因素分析
100例NB患儿中,复发34例,未复发66例。单因素分析结果显示,年龄、肿瘤远处转移、放疗是NB患儿肿瘤复发的影响因素(P < 0.05), 见表 1。
表 1 NB患儿肿瘤复发的单因素分析[n(%)]因素 分类 复发患儿(n=34) 未复发患儿(n=66) χ2 P 年龄 < 18个月 6(17.65) 34(51.52) 10.725 0.001 ≥18个月 28(82.35) 32(48.48) 性别 男 16(47.06) 40(60.61) 1.671 0.196 女 18(52.94) 26(39.39) 原发部位 肾上腺/腹膜后 24(70.59) 42(63.64) 0.483 0.487 其他 10(29.41) 24(36.36) 远处转移 是 30(88.24) 26(39.39) 21.725 < 0.001 否 4(11.76) 40(60.61) 24 h尿VMA < 13.6 mg 16(47.06) 38(57.58) 0.999 0.318 ≥13.6 mg 18(52.94) 28(42.42) MYCN基因扩增 是 18(52.94) 22(33.33) 3.595 0.058 否 16(47.06) 44(66.67) 血清NSE < 100 μg/L 14(41.18) 38(57.58) 2.418 0.120 ≥100 μg/L 20(58.82) 28(42.42) 放疗 是 12(35.29) 46(69.70) 10.903 0.001 否 22(64.71) 20(30.30) VMA: 香草扁桃酸; NSE: 神经元特异性烯醇化酶。 2.2 NB患儿生存情况的单因素分析
100例NB患儿中,生存74例,死亡26例。单因素分析结果显示,年龄、肿瘤远处转移、MYCN基因扩增是NB患儿生存情况的影响因素(P < 0.05), 见表 2。
表 2 NB患儿生存情况的单因素分析[n(%)]因素 分类 生存患儿(n=74) 死亡患儿(n=26) χ2 P 年龄 < 18个月 36(48.65) 4(15.38) 8.870 0.003 ≥18个月 38(51.35) 22(84.62) 性别 男 38(51.35) 18(69.23) 2.496 0.114 女 36(48.65) 8(30.77) 原发部位 肾上腺/腹膜后 52(70.27) 14(53.85) 2.313 0.128 其他 22(29.73) 12(46.15) 远处转移 是 34(45.95) 22(84.62) 11.676 0.001 否 40(54.05) 4(15.38) 24 h尿VMA < 13.6 mg 42(56.76) 12(46.15) 0.871 0.351 ≥13.6 mg 32(43.24) 14(53.85) MYCN基因扩增 是 20(27.03) 20(76.92) 19.958 < 0.001 否 54(72.97) 6(23.08) 血清NSE < 100 μg/L 42(56.76) 10(38.46) 2.580 0.108 ≥100 μg/L 32(43.24) 16(61.54) 放疗 是 46(62.16) 12(46.15) 2.024 0.155 否 28(37.84) 14(53.85) 2.3 放疗组与未放疗组NB患儿无复发生存率比较
随访记录放疗组与未放疗组NB患儿的无复发生存期,放疗组随访时间为7.36~24.73个月,未放疗组随访时间为6.33~22.60个月。随访期间,放疗组12例患儿复发,复发率为20.69%(12/58), 平均复发时间为19.61个月; 未放疗组22例患儿复发,复发率为52.38%(22/42), 平均复发时间为15.24个月。Kaplan-Meier法生存分析结果显示, 2组患儿无复发生存率比较差异有统计学意义(P < 0.05), 表明放疗可显著提升NB患儿无复发生存率,见图 1。
2.4 放疗组与未放疗组NB总生存率的比较
随访记录放疗组与未放疗组NB患儿的总生存期,放疗组随访时间为9.26~29.77个月,未放疗组随访时间为6.70~25.68个月。随访期间,放疗组、未放疗组分别死亡12、14例,平均总生存时间分别为25.19、20.89个月,总生存率分别为79.31%(46/58)、66.67%(28/42)。Log-rank检验结果显示,2组患儿总生存率比较差异无统计学意义(P>0.05), 表明放疗并不能显著提升NB患儿的总生存率,见图 2。
3. 讨论
NB是一种严重威胁儿童健康的常见恶性肿瘤,在中国的发病率为3/1 000 000~55/1 000 000[10]。NB起病隐匿,多数原发于肾上腺及腹膜后,大部分患儿确诊时已属高危NB, 容易复发和转移,预后较差。NB患儿的肿瘤复发率和生存率可能与多种因素相关。本研究结果显示,年龄、肿瘤远处转移均为NB复发和生存的影响因素(P < 0.05)。刘涛等[11]研究发现,伴有骨转移和颅内转移的高危NB患儿预后较差,其中颅内转移是预后的独立危险因素,但骨髓转移对高危NB预后的影响不明显。本研究中,由于不同部位远处转移的病例数较少,未分别进行统计学分析。MYCN基因扩增可促进肿瘤血管形成和远处转移,与NB的不良预后密切相关[12]。本研究单因素分析结果证实, MYCN基因扩增是NB患儿生存率的危险因素。VMA、NSE在NB的早期诊断和预后判断方面具有一定价值,尤其是NSE>100 ng/mL者预后不佳[13]。但本研究单因素分析结果显示, VMA、NSE水平升高对NB患儿的肿瘤复发率和生存率均无显著影响,考虑与样本量不足以及部分患儿随访时间较短有关[14]。
虽然无事件生存率(EFS)已被认为是评估肿瘤预后的重要指标之一,但仍存在一定局限性。临床事件的概念相对模糊,不仅包括疾病的复发和进展,还包括疾病造成的死亡、治疗带来的副作用和其他意外情况。此外,导致肿瘤进展、复发和患者死亡的机制可能不同,一些已知的预后因素(年龄、INSS分期、远处转移、MYCN基因扩增等)可能难以准确预测NB患儿的肿瘤复发和生存情况。鉴于此,本研究回顾性分析基于无复发生存率的预后因素,并深入了解放疗对NB无复发生存率的影响。国内研究[3]报道,经综合治疗后高危NB患儿的长期生存率仍低于50%, 与国外研究[15]报道的生存率74%相比仍有差距。因诱导化疗效果欠佳或肿瘤被血管包绕,高危NB常无法通过手术完整切除。周珺珺等[16]研究显示,对术后残留肿瘤床辅以局部放疗干预, NB患者的局部控制率和长期生存率相较于完整切除患者并无显著差异,推测放疗对局部控制率和长期生存率的提升有显著作用。本研究中,放疗组与未放疗组的无复发生存率差异有统计学意义(P < 0.05), 表明放疗可显著提升患儿的无瘤生存时间。
目前,传统放疗方法仍有较多副作用,例如高强度放疗可导致患儿发育异常、血管纤维化、甲状腺功能减退等[17], 尤其是大剂量化疗后再进行全身放疗,将可能诱发第2处原发肿瘤。因此,放疗能否提升NB患儿的长期生存率仍未明确[6]。本研究中,放疗组与未放疗组NB患儿的总生存率差异无统计学意义,与单因素分析中放疗因素对NB生存率的影响结果相一致,提示传统放疗难以提升NB患儿的长期生存率。近年来,调强适形放疗、三维适形放疗等精准放疗技术被逐渐应用于临床,其能够增强放疗效果并减轻放疗副作用,或许在改善NB患儿总体生存率方面具有一定意义[18]。
综上所述,年龄、肿瘤远处转移、放疗是NB复发的影响因素,年龄、肿瘤远处转移、MYCN基因扩增是NB患儿生存情况的影响因素。高危NB患儿的治疗目标是降低肿瘤复发率、提升长期生存率和改善生存质量。传统放疗方法能显著提升高危NB患儿的无复发生存率,但不能显著提升总生存率。未来研究者可针对高危NB患儿的预后进一步开展大样本量前瞻性随机对照研究,从而为NB的精准治疗提供参考依据。
-
表 1 2组患者临床资料比较(x±s)[n(%)]
指标 分类 非贫血组(n=62) 肾性贫血组(n=86) t/χ2 P 性别 男 30(48.39) 49(56.98) 1.068 0.301 女 32(51.61) 37(43.02) 年龄/岁 54.87±10.08 55.12±9.93 0.150 0.881 体质量指数/(kg/m2) 23.62±2.13 23.48±2.02 0.407 0.685 糖尿病 20(32.26) 30(34.88) 0.111 0.739 高血压 46(74.19) 76(88.37) 5.001 0.025 治疗方案 血液透析 40(64.52) 66(76.74) 2.673 0.263 血液透析+血液透析滤过 18(29.03) 16(18.60) 血液透析+血液透析滤过+血液灌流 4(6.45) 4(4.65) 血管通路 临时导管 4(6.45) 5(5.81) 0.194 0.907 长期导管 7(11.29) 8(9.30) 动静脉内瘘 51(82.26) 73(84.88) 透析龄/月 38.39±7.62 35.91±8.04 1.892 0.060 促红细胞生成素/(mIU/mL) 18.53±3.89 5.62±2.81 23.450 < 0.001 1周促红细胞生成素用量/(U/kg) 134.06±28.15 137.62±26.47 0.786 0.433 服用α-骨化醇 56(90.32) 48(55.81) 20.536 < 0.001 总胆固醇/(mmol/L) 3.88±1.12 3.59±1.05 1.612 0.109 甘油三酯/(mmol/L) 1.65±0.53 1.42±0.49 2.722 0.007 低密度脂蛋白胆固醇/(mmol/L) 2.40±0.92 2.18±0.73 1.621 0.107 高密度脂蛋白胆固醇/(mmol/L) 1.05±0.25 0.96±0.31 1.886 0.061 白蛋白/(g/L) 31.42±7.32 28.06±6.95 2.838 0.005 红细胞比容/% 0.36±0.11 0.32±0.14 1.871 0.063 红细胞分布宽度标准差 48.52±9.17 48.39±8.55 0.089 0.930 红细胞分布宽度变异系数 14.44±2.72 14.29±2.45 0.351 0.726 血小板/(×109/L) 183.96±77.02 180.65±72.38 0.267 0.790 血小板分布宽度/% 12.21±2.39 11.58±2.42 1.571 0.118 中性粒细胞与淋巴细胞比值/% 3.31±1.12 5.46±2.35 6.674 < 0.001 C反应蛋白/(mg/L) 11.64±2.39 15.08±3.72 6.389 < 0.001 血尿素氮/(mmol/L) 22.73±4.62 23.15±4.89 0.527 0.599 血肌酐/(mmol/L) 912.37±206.45 903.51±217.66 0.250 0.803 尿酸/(μmol/L) 418.92±89.72 406.53±90.28 0.826 0.410 β2-微球蛋白/(mg/L) 30.42±7.55 30.76±7.68 0.268 0.789 胱抑素C/(mg/L) 5.58±1.42 5.39±1.55 0.762 0.447 碱性磷酸酶/(U/L) 84.22±19.06 79.78±25.39 1.161 0.248 二氧化碳结合力/% 21.04±3.45 21.83±3.71 1.316 0.190 总铁结合力/% 45.39±19.07 41.15±22.18 1.216 0.226 血清铁/(μmol/L) 13.18±4.02 12.25±3.91 1.411 0.160 血清铁蛋白/(μg/L) 178.69±39.64 218.72±47.06 5.447 < 0.001 转铁蛋白饱和度/% 26.42±7.47 24.83±8.01 1.225 0.222 全段甲状旁腺激素/(pg/mL) 316.82±72.31 562.93±99.58 16.560 < 0.001 表 2 多因素Logistic回归分析筛选影响ESKD血液透析患者肾性贫血的因素
因素 β SE Wald χ2 P OR(95%CI) 高血压 1.465 0.485 9.124 0.001 4.326(3.872~4.903) 服用α-骨化醇 -0.666 0.402 2.745 0.046 0.514(0.175~0.864) EPO升高 -0.891 0.637 1.956 0.027 0.410(0.134~0.764) TG升高 -0.955 0.612 2.435 0.023 0.385(0.102~0.667) ALB升高 -0.860 0.651 1.745 0.037 0.423(0.106~0.742) NLR增加 1.354 0.569 5.663 0.010 3.871(3.255~4.369) CRP升高 1.380 0.513 7.236 0.003 3.975(3.084~4.902) SF升高 1.519 0.438 12.027 < 0.001 4.569(3.705~5.362) iPTH升高 1.184 0.593 3.987 0.017 3.266(2.885~3.711) 表 3 不同肾性贫血概率模型对肾性贫血的预测效果
概率 准确度/% 敏感度/% 特异度/% 假阳性率/% 假阴性率/% 约登指数 0.95 77.82 87.12 77.31 65.02 2.49 64.43 0.90 80.14 87.04 80.69 59.27 2.50 67.73 0.85 85.09 86.59 85.52 55.02 3.12 72.11 0.80 93.77 86.42 92.85 41.28 3.27 79.27 0.75 93.29 86.21 92.06 36.43 3.47 78.27 0.70 92.81 83.63 93.17 32.79 4.22 76.80 0.65 93.08 80.24 93.85 30.36 4.39 74.09 0.60 92.37 78.23 93.43 29.57 5.21 71.66 0.55 93.56 75.06 93.39 28.12 5.69 68.45 0.50 94.01 70.18 94.08 37.43 6.31 64.26 0.45 93.72 67.93 94.26 24.11 6.45 62.19 0.40 93.28 66.86 96.32 22.38 6.82 63.18 0.35 93.15 60.95 97.28 20.09 7.15 58.23 0.30 90.79 57.13 98.17 18.73 7.29 55.30 0.25 87.62 54.39 99.24 13.46 8.05 53.63 0.20 87.13 47.12 99.83 7.02 8.78 46.95 0.15 86.05 32.45 99.69 4.28 9.42 32.14 0.10 85.44 19.76 100.00 < 0.01 10.13 19.76 0.05 86.07 < 0.01 100.00 < 0.01 10.59 < 0.01 表 4 十字交叉试验验证模型预测肾性贫血的稳定性
% 模型 准确度 敏感度 特异度 假阳性率 假阴性率 训练集 93.77 86.42 92.85 41.28 3.27 验证集 92.34 85.66 92.37 40.65 3.59 -
[1] JANKOWSKI J, FLOEGE J, FLISER D, et al. Cardiovascular disease in chronic kidney disease: pathophysiological insights and therapeutic options[J]. Circulation, 2021, 143(11): 1157-1172. doi: 10.1161/CIRCULATIONAHA.120.050686
[2] LIU P, QUINN R R, LAM N N, et al. Accounting for age in the definition of chronic kidney disease[J]. JAMA Intern Med, 2021, 181(10): 1359-1366. doi: 10.1001/jamainternmed.2021.4813
[3] GERRITS T, BROUWER I J, DIJKSTRA K L, et al. Endoglin is an important mediator in the final common pathway of chronic kidney disease to end-stage renal disease[J]. Int J Mol Sci, 2022, 24(1): 646. doi: 10.3390/ijms24010646
[4] WANG X F, SHI Q Y, MO Y Z, et al. Palliative care needs and symptom burden in younger and older patients with end-stage renal disease undergoing maintenance hemodialysis: a cross-sectional study[J]. Int J Nurs Sci, 2022, 9(4): 422-429.
[5] GONG Y, XIE L Y, YU S Q. Long-term In-center nocturnal hemodialysis improves renal Anemia and malnutrition and life quality of older patients with chronic renal failure[J]. Clin Interv Aging, 2022, 17: 915-923. doi: 10.2147/CIA.S358472
[6] TSAI M H, SU F Y, CHANG H Y, et al. The effect of statin on Anemia in patients with chronic kidney disease and end-stage kidney disease: a systematic review and meta-analysis[J]. J Pers Med, 2022, 12(7): 1175. doi: 10.3390/jpm12071175
[7] KU E, DEL VECCHIO L, ECKARDT K U, et al. Novel anemia therapies in chronic kidney disease: conclusions from a Kidney Disease: improving Global Outcomes (KDIGO) Controversies Conference[J]. Kidney Int, 2023, 104(4): 655-680. doi: 10.1016/j.kint.2023.05.009
[8] 孙雪峰. 《中国肾性贫血诊疗的临床实践指南》解读[J]. 中国实用内科杂志, 2021, 41(9): 785-788. [9] UMBOH O, MOIES E S, PALAR S. The effect of Anemia and hypoalbuminemia on six-months hospitalization risk in end stage chronic kidney disease patients undergoing hemodialysis: a retrospective cohort study[J]. Acta Med Indones, 2023, 55(2): 136-141.
[10] AGORO R, WHITE K E. Anemia and fibroblast growth factor 23 elevation in chronic kidney disease: homeostatic interactions and emerging therapeutics[J]. Curr Opin Nephrol Hypertens, 2022, 31(4): 320-325. doi: 10.1097/MNH.0000000000000797
[11] GUTIÉRREZ O M. Treatment of iron deficiency Anemia in CKD and end-stage kidney disease[J]. Kidney Int Rep, 2021, 6(9): 2261-2269. doi: 10.1016/j.ekir.2021.05.020
[12] RASHIDI A, GARIMELLA P S, AL-ASAAD A, et al. Anemia management in the cancer patient with CKD and end-stage kidney disease[J]. Adv Chronic Kidney Dis, 2022, 29(2): 180-187. e1. doi: 10.1053/j.ackd.2022.03.005
[13] 王静, 温向琼, 康婷, 等. 维持性血液透析患者肾性贫血与中性粒细胞/淋巴细胞比值的相关性[J]. 西部医学, 2023, 35(2): 242-246. doi: 10.3969/j.issn.1672-3511.2023.02.017 [14] 李霞, 陈育青. 影响维持性血液透析患者促红细胞生成素抵抗的因素分析[J]. 重庆医学, 2022, 51(9): 1554-1557. doi: 10.3969/j.issn.1671-8348.2022.09.024 [15] 刘海飞, 赵晓倩, 李兆婷, 等. 老年维持性血液透析病人肾性贫血现状调查及影响因素分析[J]. 实用老年医学, 2022, 36(4): 345-349. [16] 韩蓓, 韩俊岭, 曹靖昊, 等. 全段成纤维细胞生长因子23与维持性血液透析患者肾性贫血的相关性研究[J]. 实用临床医药杂志, 2021, 25(21): 114-118. doi: 10.7619/jcmp.20213812 [17] 吕晴, 陈卫东, 刘磊. 维持性血液透析患者肾性贫血的多因素分析及相关性研究[J]. 中华全科医学, 2021, 19(5): 871-874. [18] 朱燕. 长期维持性血液透析患者发生肾性贫血的危险因素分析[J]. 现代医学与健康研究电子杂志, 2022, 6(14): 24-26.




 下载:
下载:


 苏公网安备 32100302010246号
苏公网安备 32100302010246号
