Mechanism of propofol alleviating postoperative pain in rats by regulating p38 mitogen-activated protein kinase signaling pathway
-
摘要:目的
探讨丙泊酚通过调控p38丝裂原活化蛋白激酶(MAPK)信号通路减轻大鼠术后疼痛的机制。
方法通过血管夹短暂性钳夹方式构建术后神经病理性疼痛模型,采用随机数字表法将36只SD大鼠分为对照组(未治疗)、手术组(接受PELD治疗)、手术+丙泊酚治疗组[接受PELD治疗,并通过大鼠侧尾静脉注射丙泊酚1.5 mg/(kg·min)]、手术+丙泊酚+p38MAPK激动剂Diprovocim组[接受PELD治疗,于大鼠侧尾静脉注射1.5 mg/(kg·min)丙泊酚和5 nmol/L p38MAPK激动剂Diprovocim]。连续给药14 d后,采用Von-Frey测试探头测试大鼠机械痛觉阈值,采用Hargreaves实验检测热痛觉阈值; 通过免疫荧光试验检测脊髓背角胶质细胞活化情况; 采用蛋白免疫印迹试验(Western blotting)检测磷酸化p38(p-p38)、磷酸化MAPK(p-MAPK)及下游白细胞介素-1β(IL-1β)、P53、CHOP蛋白表达水平。
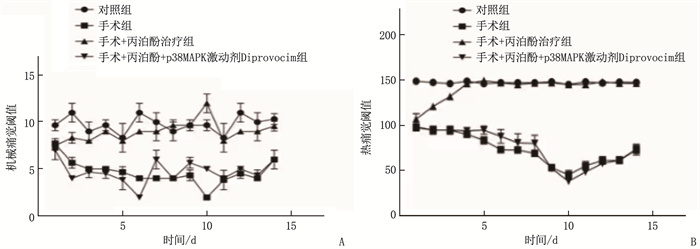
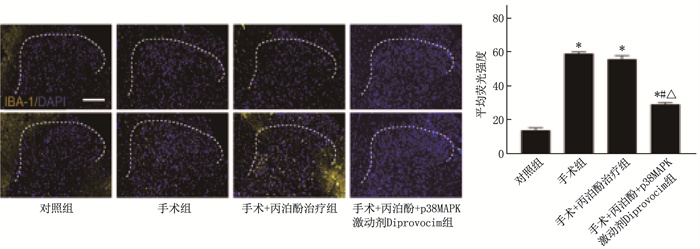
结果手术组大鼠在探针刺激下,术后12 h出现神经病理性疼痛,术后10 d疼痛达到峰值,之后疼痛逐渐缓解; 手术+丙泊酚治疗组大鼠术后12 h出现神经病理性疼痛, 24 h疼痛程度下降,术后14 d疼痛逐渐缓解; 手术+丙泊酚+p38MAPK激动剂Diprovocim组术后12 h出现神经病理性疼痛, 24 h疼痛阈值未显著下降,术后10 d疼痛达到峰值,之后症状逐渐缓解。与对照组比较,手术组P53蛋白、脊髓后角组织中p-p38与p-MAPK水平、下游IL-1β与CHOP蛋白表达水平以及术侧胶质细胞活化程度升高,差异有统计学意义(P < 0.05)。与手术组比较,手术+丙泊酚治疗组p-p38、p-MAPK水平,下游IL-1β、P53、CHOP蛋白表达水平,以及胶质细胞活化程度下降,差异有统计学意义(P < 0.05); 与手术+丙泊酚治疗组比较,手术+丙泊酚+p38MAPK激动剂Diprovocim组p-p38、p-MAPK水平, 以及IL-1β、P53、CHOP蛋白表达水平下降,差异有统计学意义(P < 0.05)。
结论丙泊酚可以通过p38MAPK信号通路减轻大鼠术后疼痛。
-
关键词:
- 丙泊酚 /
- 术后神经病理性疼痛 /
- p38丝裂原活化蛋白激酶信号通路 /
- 细胞活化
Abstract:ObjectiveTo explore the potential mechanism of propofol in relieving postoperative pain in rats through p38 mitogen-activated protein kinase (MAPK) signaling pathway.
MethodsA postoperative neuropathic pain model was constructed by transient clamping with vascular clips, and thirty-six SD rats were randomly divided into four groups using a random number table method: control group (untreated), surgery group (receiving PELD treatment), surgery+propofol treatment group [receiving PELD treatment and an intravenous injection of propofol at 1.5 mg/(kg·min) through the lateral tail vein of the rats], and surgery+propofol+p38MAPK agonist Diprovocim group [receiving PELD treatment, with an intravenous injection of 1.5 mg/(kg·min) propofol and 5 nmol/L of the p38MAPK agonist Diprovocim through the lateral tail vein of the rats]. After 14 d of continuous drug administration, the rats were tested for mechanical nociceptive thresholds using the Von-Frey test probe, and thermal nociceptive thresholds were detected by the Hargreaves experiment; the activation of spinal cord dorsal horn glial cells was detected by immunofluorescence assay; p38 phosphorylation (p-p38), MAPK phosphorylation(p-MAPK) and downstream interleukin-1β (IL-1β), P53, and CHOP protein expression levels were detected by immunoprotein blotting assay (Western blotting).
ResultsRats in the surgery group exhibited neuropathic pain 12 hours postoperatively ollowing probe stimulation, with pain peaking on postoperative day 10 and gradually subsiding thereafter. Rats in the surgery + propofol treatment group also experienced neuropathic pain 12 hours postoperatively, but the pain intensity decreased at 24 hours, and gradually subsided by postoperative day 14. Rats in the surgery+propofol+p38MAPK agonist Diprovocim group developed neuropathic pain 12 hours postoperatively, with no significant decrease in pain threshold at 24 hours, and pain peaked on postoperative day 10 before gradually subsiding. Compared with the control group, the surgery group showed increased levels of P53 protein, p-p38 and p-MAPK in the posterior horn of the spinal cord, increased expression of downstream interleukin-1β (IL-1β) and CHOP proteins, and enhanced glial cell activation on the operated side (P < 0.05). When compared with the surgery group, the surgery+propofol treatment group exhibited decreased levels of p-p38, p-MAPK, and downstream IL-1β, P53, and CHOP protein expression, as well as reduced glial cell activation (P < 0.05).Conclusion with the surgery+propofol treatment group, the surgery+propofol+p38MAPK agonist Diprovocim group showed decreased expression levels of IL-1β, P53, and CHOP proteins and levels of p-p38, p-MAPK (P < 0.05).
ConclusionPropofol can relieve postoperative pain in rats through p38MAPK signaling pathway.
-
慢性萎缩性胃炎(CAG)是一种由多种原因引起的胃部疾病, 胃黏膜发生慢性炎症反应,同时有腺体萎缩的病理表现,甚至出现更严重的细胞学改变,如肠化、异型增生等,属于癌前疾病[1]。电子胃镜检查在消化疾病诊疗中的应用越来越普遍, CAG的检出率大幅提升[2]。目前西医主要应用质子泵抑制剂(PPI)类抑酸药如奥美拉唑、雷贝拉唑等进行治疗,该类药与H-K-ATP酶结合,抑制胃酸分泌,或同时应用多潘立酮等促进胃肠动力的药物,或补充微量元素、加强黏膜营养等,症状虽有改善,但对CAG胃黏膜的病理改变及CAG引起的胃肠功能障碍疗效不明显[3]。中医药治疗CAG不仅能够改善症状,而且可以延缓病情进展,在逆转病理表现方面,优势也愈发明显[4]。本研究应用中药汤剂化浊通清饮治疗CAG浊毒内蕴证,探讨其对胃黏膜病理的影响,现报告如下。
1. 资料与方法
1.1 一般资料
选择2021年6月—2022年1月在河北省中医院脾胃病科门诊及病房就诊的159例CAG患者为研究对象,随机分为中药组、西药组和对照组,每组53例。中药组男27例,女26例,年龄25~69岁,平均(51.13±8.36)岁; 平均病程为(4.51±0.63)年; 男性平均体质量(72.67±15.94) kg, 女性平均体质量(61.59±12.75)kg。西药组男24例,女29例,年龄26~68岁,平均(49.62±7.97)岁; 平均病程为(4.36±0.61)年; 男性平均体质量(73.51±14.74) kg, 女性平均体质量(59.46±14.25) kg。对照组男25例,女28例,年龄26~70岁,平均(50.87±8.19)岁; 平均病程为(4.27±0.59)年; 男性平均体质量(71.36±16.27) kg, 女性平均体质量(62.84±13.41) kg。3组患者一般资料比较,差异无统计学意义(P>0.05), 具有可比性。
西医CAG诊断参照《中国慢性胃炎共识意见(2017年,上海)》[5]。中医证型浊毒内蕴证标准参照《慢性萎缩性胃炎中医诊疗共识意见》[6], 诊断需要包括主症中的任意2项、次症中的任意2项。主症: ①胃胀不舒; ②烧心反酸; ③胃脘疼痛; ④嗳气。次症: ①嘈杂; ②口干苦; ③恶心欲吐; ④便黏; ⑤纳差。此外,还应兼有舌质暗红或红,且苔黄、厚或腻,脉弦或滑表现。纳入标准: ①年龄25~70岁者; ②符合CAG西医及中医诊断标准者; ③了解研究方案并在知情同意书上签字者; ④无肝肾及心脑血管严重疾病者。排除标准: ①有胃出血、胃穿孔、胃恶性肿瘤及其他严重的胃部疾病者; ②对本研究中包含的药物过敏者; ③妊娠期或哺乳期妇女; ④有精神障碍者。
1.2 方法
对照组口服摩罗丹浓缩丸(邯郸制药股份有限公司,国药准字Z20090013), 1袋/次, 3次/d。西药组口服雷贝拉唑钠肠溶片[双鹤药业(海南)有限责任公司,国药准字H20110160], 10 mg/次, 1次/d。中药组口服化浊通清饮,组方为: 败酱草9 g, 蒲公英12 g, 砂仁6 g, 藿香12 g, 大腹皮9 g, 鸡骨草20 g, 石菖蒲15 g, 白梅花5 g, 佛手9 g, 娑罗子9 g, 大血藤9 g, 炒栀子10 g, 玫瑰花6 g, 香橼12 g, 炒莱菔子12 g。随症加减: 胃胀不舒甚者加枳实12 g; 胃痛甚者予延胡索12 g; 口干苦明显者予石斛9 g、麦冬9 g; 反酸烧心明显者予海螵蛸9 g; 纳差者加焦麦芽10 g、炒鸡内金12 g。水煎取汁300 mL, 分2次服用,1剂/d。
1.3 观察指标
① 胃黏膜病理组织学评分根据《中国慢性胃炎共识意见(2017年,上海)》[5], 按无(0分)、轻度(2分)、中度(4分)、重度(6分)进行评分。②中医证候评分[7]根据胃胀不舒、烧心反酸、胃脘疼痛、便黏及嗳气等症状的轻重程度进行计分,轻度2分,中度4分,重度6分。③简明健康状况调查量表(SF-36)评分[8],该量表包括8个维度、36个条目,总分100分,分数与生活质量呈正比。④采用酶联免疫吸附法(ELISA)检测血清胃泌素-17(G-17)和前列腺素E2(PGE2)水平。
1.4 疗效判定
根据《中药新药临床研究指导原则(试行)》[9]拟定疗效标准,分为痊愈、显效、有效及无效共4个等级。痊愈: 无临床不适症状,胃镜及病理检查无异常; 显效: 临床症状明显改善,胃镜下所见胃黏膜病变显著好转,显微镜下(病理)胃黏膜异常改变消失或减轻2级以上; 有效: 临床症状较前改善,胃镜下所见胃黏膜病变减少(减幅1/2以上),显微镜下(病理)胃黏膜异常改变较前减轻(减轻≥1级); 无效: 临床症状无好转,胃镜及显微镜下(病理)胃黏膜无改善。总有效率=痊愈率+显效率+有效率。
1.5 统计学方法
采用SPSS 22.0软件进行统计分析,计数资料采用[n(%)]表示,比较行χ2检验; 计量资料采用均值±标准差表示,比较行t检验。P < 0.05为差异有统计学意义。
2. 结果
2.1 3组临床疗效比较
中药组、西药组、对照组治疗总有效率依次为92.45%、62.26%和66.04%, 中药组高于西药组、对照组,差异有统计学意义(P < 0.05)。见表 1。
表 1 3组患者临床疗效比较[n(%)]组别 n 痊愈 显效 有效 无效 总有效 中药组 53 13(24.53) 24(45.28) 12(22.64) 4(7.55) 49(92.45) 西药组 53 3(5.66) 12(22.64) 18(33.96) 20(37.74) 33(62.26)* 对照组 53 6(11.32) 19(35.85) 10(18.87) 18(33.96) 35(66.04)* 与中药组比较, * P < 0.05。 2.2 3组胃黏膜病理组织学评分比较
与治疗前比较,各组治疗后腺体萎缩、肠上皮化生、异型增生、慢性炎症评分降低,且中药组上述评分低于对照组和西药组,差异有统计学意义(P < 0.05)。见表 2。
表 2 3组患者胃黏膜病理组织学评分比较(x±s)分 组别 n 时点 腺体萎缩 肠上皮化生 异型增生 慢性炎症 中药组 53 治疗前 4.31±0.63 3.36±0.83 2.48±0.56 4.56±0.75 治疗后 1.59±0.52* 1.28±0.66* 1.17±0.29* 1.62±0.41* 西药组 53 治疗前 4.25±0.61 3.29±0.81 2.43±0.48 4.55±0.68 治疗后 3.23±0.56*# 2.87±0.69*# 2.25±0.44# 2.63±0.46*# 对照组 53 治疗前 4.27±0.65 3.34±0.78 2.46±0.54 4.53±0.74 治疗后 2.91±0.48*# 2.16±0.53*# 1.91±0.31*# 2.77±0.53*# 与治疗前比较, * P < 0.05; 与中药组比较, #P < 0.05。 2.3 3组中医证候评分比较
治疗3个月后, 3组胃脘疼痛、胃胀不舒、反酸烧心、嗳气、便黏评分均低于治疗前,且中药组胃脘疼痛、胃胀不舒、反酸烧心、嗳气、便黏评分低于对照组和西药组,差异有统计学意义(P < 0.05)。见表 3。
表 3 3组患者治疗前后中医证候评分比较(x±s)分 组别 n 时点 胃脘疼痛 胃胀不舒 反酸烧心 嗳气 便黏 中药组 53 治疗前 4.36±0.61 4.59±0.73 3.27±0.56 3.41±0.48 2.97±0.64 治疗后 1.22±0.32* 1.43±0.43* 0.94±0.26* 1.18±0.33* 0.76±0.21* 西药组 53 治疗前 4.31±0.55 4.46±0.64 3.21±0.58 3.37±0.52 2.91±0.67 治疗后 2.19±0.36*# 2.76±0.51*# 1.59±0.31*# 2.48±0.46*# 2.25±0.73*# 对照组 53 治疗前 4.33±0.58 4.58±0.72 3.25±0.53 3.42±0.45 2.94±0.63 治疗后 2.24±0.38*# 2.32±0.49*# 1.68±0.35*# 2.06±0.41*# 1.57±0.38*# 与治疗前比较, * P < 0.05; 与中药组比较, #P < 0.05。 2.4 3组SF-36评分比较
3组患者治疗后1、2、3个月SF-36评分较治疗前均提高,且中药组SF-36评分高于对照组和西药组,随访时中药组评分仍高于对照组和西药组,差异有统计学意义(P < 0.05)。见表 4。
表 4 3组患者治疗前后SF-36评分比较(x±s)分 组别 n 治疗前 治疗1个月 治疗2个月 治疗3个月 随访时 中药组 53 49.68±6.46 61.32±7.11* 74.15±9.51* 85.33±10.72* 86.47±10.54* 西药组 53 51.09±6.74 56.67±6.58*# 61.84±7.82*# 68.76±8.54*# 62.86±6.43*# 对照组 53 50.34±6.93 55.42±7.57*# 63.46±8.64*# 71.59±9.43*# 65.92±9.36*# SF-36: 生活质量量表。与治疗前比较, * P < 0.05; 与中药组比较, #P < 0.05。 2.5 3组血清G-17和PGE2水平比较
治疗后, 3组患者血清G-17和PGE2水平均较治疗前升高,且中药组血清G-17和PGE2水平高于西药组和对照组,差异有统计学意义(P < 0.05)。见表 5。3组患者治疗期间均无不良反应发生。
表 5 3组患者治疗前后血清G-17和PGE2比较(x±s)组别 n 时点 G-17/(pmol/L) PGE2/(ng/mL) 中药组 53 治疗前 4.23±0.66 2.76±0.43 治疗后 11.08±1.73* 7.01±0.55* 西药组 53 治疗前 4.18±0.67 2.75±0.44 治疗后 6.57±0.81*# 3.96±0.43*# 对照组 53 治疗前 4.21±0.64 2.78±0.41 治疗后 7.14±0.92*# 4.97±0.48*# G-17: 胃泌素-17; PGE2: 前列腺素E2。
与治疗前比较, * P < 0.05; 与中药组比较, #P < 0.05。3. 讨论
CAG患者缺乏特异性临床表现,易出现各种消化不良症状,如胃胀不舒、嗳气、胃脘疼痛、恶心、大便黏腻等,其病因包括生物因素(Hp感染)、化学因素(非甾体抗炎药)、物理因素(咖啡、浓茶等)、免疫遗传因素等[10], 各种危险因子反复损伤胃黏膜表面,导致胃黏膜内炎性细胞浸润,胃黏膜充血水肿,出现慢性炎症反应,进一步发展为腺体萎缩减少、胃黏膜变薄,导致黏膜下血管显露,胃蠕动功能障碍,即CAG, 并可能进展为肠上皮化生(胃正常细胞被杯状细胞代替)或异型增生。该病早期症状不明显、不被重视,患者多因症状加重或迁延不愈就诊,导致癌变风险加大,治疗周期延长[11]。
近年来,中医药在治疗CAG方面应用广泛。CAG可归于中医“痞满”“胃脘痛”“心下痞”“嘈杂”等范畴[12]。CAG病位在胃腑,与脾脏功能密不可分。《黄帝内经·经脉别论》曰: “饮入于胃,游溢精气,上输于脾,脾气散精……水精四布,五精并行,合于四时五脏之阴阳,揆度以为常也。”脾胃互助,输布胃之津液,全身脏器得到濡养。脾脏和胃腑同居中焦,是气血生化之源,亦被称为后天之本。脾脏主运化,脾气以升为健。胃腑主受纳,胃气以和降为顺。《素问·阴阳应象大论》记载: “清气在下,则生飧泄,浊气在上,则生(月真)胀。”脾脏和胃腑相辅相成,同时也相互影响。本研究认为,浊毒内蕴是导致CAG发病的重要机制,饥饱不定、情志欠佳及外邪入侵等因素,可致脾胃受纳运化功能受损,日久湿浊热毒蕴于中焦,固结不散,以致气滞络瘀,血不养经,胃腑缺乏滋养,使胃黏膜炎症、萎缩及肠化等病变相继出现。根据以上病机组方化浊通清饮: 败酱草可清热解毒破瘀,味辛、苦,其性微寒[13], 其中的有效成分具有抗炎、抗菌的作用,对胃肠道疾病如慢性胃炎、炎症性肠病等有明显疗效; 蒲公英能够清热解毒、利湿消肿[14], 有抗炎、抗氧化、抗肿瘤、改善胃肠功能等作用; 砂仁化浊理气开胃[15], 可减轻炎症,促进胃黏膜修复,改善胃肠蠕动功能; 藿香可化浊和中止呕[16], 其醇提物能够调控核因子-kB(NF-kB)信号通路,抑制炎症反应,减轻小鼠胃黏膜损伤,促进受损的胃黏膜得到修复; 鸡骨草可清热利湿止痛,具有抗肿瘤、抗氧化、抑制幽门螺旋杆菌及抗炎等作用[17]; 大腹皮宽中下气,能够增加胃肠激素的分泌,兴奋迷走神经,改善胃肠动力[18]; 石菖蒲归心、胃经,具有化湿理气活血以及健胃、抑制胃肠痉挛等作用[19]; 大血藤味苦、平,具有清热活血止痛功效; 白梅花、玫瑰花能疏肝和胃,散结止痛; 香橼、娑罗子及佛手可理气行滞、和胃宽中; 炒栀子清热利湿、凉血除烦; 炒莱菔子降气除胀; 全方治疗以清热化浊、解毒和胃为主,以行气活血宽中为辅,可使浊毒化解,气血畅达,促进脾胃升降功能恢复正常,胃络得以濡养,从而达到改善腺体萎缩、逆转肠化和异型增生的功效。
本研究结果显示,化浊通清饮治疗CAG后,中药组治疗总有效率高于西药组和对照组; 治疗后,中药组在改善胃脘疼痛、胃胀不舒、反酸烧心、嗳气及便黏等中医证候评分方面较西药组和对照组效果更加显著。3组患者胃黏膜病理组织学评分在治疗3个月时显著降低,表明患者胃黏膜病理情况较前明显改善,且中药组对患者胃黏膜的萎缩、肠化、异型增生及慢性炎症的改善程度更显著。中药组、西药组和对照组在治疗1、2、3个月后生活质量均有提高,且中药组显著优于西药组和对照组; 在治疗结束3个月后的随访中,中药组患者症状无明显反复,生活质量评分较高。由此可见,化浊通清饮治疗CAG能够改善临床症状,逆转病理改变,提高患者整体生活质量,且其长期疗效明显,降低了CAG的复发率。
G-17是一种可调节胃酸分泌的胃肠激素,由胃窦部G细胞产生,胃黏膜生长与其密切相关,当患有CAG时,胃窦部G细胞总数变少,血清G-17含量下降,因而可有效评估CAG的病变程度。PGE2是胃肠道十分重要的调控因子,能刺激胃黏膜产生黏液和碳酸氢盐,并且可调控胃酸-胃蛋白酶原的分泌,改善胃黏膜血流,使胃黏膜细胞不断更新,从而促进胃黏膜修复, CAG患者机体的PGE2水平较正常人群明显降低。本研究结果显示,治疗后3组患者G-17和PGE2均较治疗前增加,但中药组增加更明显,表明应用化浊通清饮治疗慢性萎缩性胃炎可增加PGE2分泌,从而促进胃黏膜修复,同时G-17的分泌水平得到提高,进而改善胃黏膜病理状态。
-
表 1 免疫荧光试验检测脊髓背角细胞活化情况(x±s)
组别 小胶质细胞数量/×103 对照组 16.52±2.05 手术组 58.56±6.45* 手术+丙泊酚治疗组 56.30±5.12* 手术+丙泊酚+p38MAPK激动剂Diprovocim组 36.15±3.41*#△ 与对照组比较, * P < 0.05; 与手术组比较, #P < 0.05;
与手术+丙泊酚治疗组比较, △P < 0.05。表 1 免疫荧光试验检测脊髓背角细胞活化情况(x±s)
组别 小胶质细胞数量/×103 对照组 16.52±2.05 手术组 58.56±6.45* 手术+丙泊酚治疗组 56.30±5.12* 手术+丙泊酚+p38MAPK激动剂Diprovocim组 36.15±3.41*#△ 与对照组比较, * P < 0.05; 与手术组比较, #P < 0.05;
与手术+丙泊酚治疗组比较, △P < 0.05。表 2 各组p-p38、p-MAPK水平以及IL-1β、P53、CHOP蛋白水平比较(x±s)
组别 p-p38 p-MAPK IL-1β P53 CHOP 对照组 1.25±0.34 1.69±0.41 1.31±0.36 1.56±0.40 1.71±0.46 手术组 3.85±0.97* 4.36±1.20* 4.33±1.18* 4.74±1.20* 4.10±1.11* 手术+丙泊酚治疗组 2.89±0.71*# 2.63±0.56*# 3.50±0.62*# 3.73±0.66*# 3.20±0.69*# 手术+丙泊酚+p38MAPK激动剂Diprovocim组 2.12±0.54*#△ 2.51±0.60*#△ 2.30±0.59*#△ 3.64±0.75*#△ 2.20±0.55*#△ 与对照组比较, * P < 0.05; 与手术组比较, #P < 0.05; 与手术+丙泊酚治疗组比较, △P < 0.05。 表 2 各组p-p38、p-MAPK水平以及IL-1β、P53、CHOP蛋白水平比较(x±s)
组别 p-p38 p-MAPK IL-1β P53 CHOP 对照组 1.25±0.34 1.69±0.41 1.31±0.36 1.56±0.40 1.71±0.46 手术组 3.85±0.97* 4.36±1.20* 4.33±1.18* 4.74±1.20* 4.10±1.11* 手术+丙泊酚治疗组 2.89±0.71*# 2.63±0.56*# 3.50±0.62*# 3.73±0.66*# 3.20±0.69*# 手术+丙泊酚+p38MAPK激动剂Diprovocim组 2.12±0.54*#△ 2.51±0.60*#△ 2.30±0.59*#△ 3.64±0.75*#△ 2.20±0.55*#△ 与对照组比较, * P < 0.05; 与手术组比较, #P < 0.05; 与手术+丙泊酚治疗组比较, △P < 0.05。 -
[1] 蒋晨浩, 蔡靓羽, 张建楠, 等. 循经体外冲击波联合针刺补泻"五输穴"治疗血瘀型腰椎间盘突出症的疗效观察[J]. 实用临床医药杂志, 2022, 26(4): 46-49. [2] ZHOU M, THEOLOGIS A A, O′CONNELL G D. Understanding the etiopathogenesis of lumbar intervertebral disc herniation: From clinical evidence to basic scientific research[J]. JOR Spine, 2023, 7(1): 1289.
[3] FENG Y, CAI F, CHEN L, et al. Excessive swelling of nerve roots: Important factor for recurring sciatica after lumbar surgery[J]. Orthopade, 2020, 49(6): 502-509. doi: 10.1007/s00132-019-03794-7
[4] ZHANG A S, XU A, ANSARI K, et al. Lumbar disc herniation: Diagnosis and management[J]. Am J Med, 2023, 136(7): 645-651. doi: 10.1016/j.amjmed.2023.03.024
[5] 李新巧, 单前前, 徐元屿, 等. 神经根脉冲射频对腰椎间盘突出症术后残余神经痛的影响[J]. 实用临床医药杂志, 2023, 27(6): 91-95. doi: 10.7619/jcmp.20223147 [6] SHENG Y, ZHOU X, WANG J, et al. MSC derived EV loaded with miRNA-22 inhibits the inflammatory response and nerve function recovery after spinal cord injury in rats[J]. J Cell Mol Med, 2021, 25(21): 10268-10278. doi: 10.1111/jcmm.16965
[7] 程艳彬, 朱清广, 孔令军, 等. p38MAPK信号通路与神经病理性疼痛的脊髓中枢敏化关系研究进展[J]. 西部中医药, 2022, 35(11): 149-152. [8] 韩秋霞, 齐芳, 杜洪印. 丙泊酚通过调节脊柱GluN2B-p38MAPK/EPAC1通路减轻大鼠术后疼痛[J]. 中国老年学杂志, 2022, 42(11): 2819-2822. [9] 赵亮, 李丹, 刘囡, 等. 抑制水通道蛋白4可降低脊髓后角胶质细胞细胞外调节蛋白激酶信号的活化改善坐骨神经损伤导致的神经病理性疼痛[J]. 解剖学报, 2019, 50(1): 35-39. [10] 张弘来, 高飞, 陈霄雷, 等. 丙泊酚通过调节脊柱GluN2B-p38 MAPK/EPAC1通路减轻慢性收缩损伤引起的神经性疼痛的大鼠模型研究[J]. 临床和实验医学杂志, 2021, 20(3): 237-241. [11] LI J, WEI Y, ZHOU J, et al. Activation of locus coeruleus-spinal cord noradrenergic neurons alleviates neuropathic pain in mice via reducing neuroinflammation from astrocytes and microglia in spinal dorsal horn[J]. J Neuroinflammation, 2022, 19(1): 123. http://pubmed.ncbi.nlm.nih.gov/35624514/
[12] ALI N H, AL-KURAISHY H M, AL-GAREEB A I, et al. BDNF/TrkB activators in Parkinson's disease: A new therapeutic strategy[J]. J Cell Mol Med, 2024, 28(10): 18368. http://openurl.ebsco.com/contentitem/doi:10.1111%2Fjcmm.18368?sid=ebsco:plink:crawler&id=ebsco:doi:10.1111%2Fjcmm.18368
[13] CHU J, YANG J, ZHOU Y, et al. ATP-releasing SWELL1 channel in spinal microglia contributes to neuropathic pain. Sci Adv, 2023, 9(13): 9931.
[14] KOHNO K, SHIRASAKA R, YOSHIHARA K, et al. A spinal microglia population involved in remitting and relapsing neuropathic pain[J]. Science, 2022, 376(6588): 86-90. http://qikan.cqvip.com/Qikan/Article/Detail?id=7106965243
[15] 曹静, 刘海波, 安琪, 等. 二甲双胍缓解小鼠放射性皮炎引起的病理性疼痛: 基于抑制p38MAPK/NF-κB信号通路[J]. 南方医科大学学报, 2023, 43(10): 1815-1820.




 下载:
下载:

 苏公网安备 32100302010246号
苏公网安备 32100302010246号
