Change in levels of molecules related to inflammation and immune regulation in peripheral blood of patients with lupus nephritis and their values in predicting prognosis
-
摘要:目的
分析狼疮性肾炎(LN)患者外周血高迁移率族蛋白B1(HMGB1)、白细胞介素-32(IL-32)、基质金属蛋白酶-9(MMP-9)/基质金属蛋白酶抑制剂-1(TIMP-1)水平变化及其预测预后的价值。
方法选取2021年10月—2023年6月收治的86例LN患者为研究对象, 均给予诱导治疗6个月,再根据病情缓解情况分为缓解组(66例)和无反应组(20例)。比较2组基线资料、HMGB1、IL-32、MMP-9/TIMP-1水平变化及降低率; 分析外周血HMGB1、IL-32、MMP-9/TIMP-1水平降低率与治疗应答的偏相关性以及预测治疗应答的价值; 比较不同HMGB1、IL-32、MMP-9/TIMP-1降低率患者病情进展情况。
结果缓解组治疗1、3个月后HMGB1、IL-32、MMP-9/TIMP-1水平较治疗前降低,差异有统计学意义(P < 0.05); 缓解组治疗1、3个月后HMGB1、IL-32、MMP-9/TIMP-1水平低于无反应组,差异有统计学意义(P < 0.05); 缓解组治疗1、3个月后HMGB1、IL-32、MMP-9/TIMP-1水平降低率高于无反应组,差异有统计学意义(P < 0.05)。偏相关性分析显示, HMGB1、IL-32、MMP-9/TIMP-1水平降低率与治疗应答独立相关(P < 0.05); 治疗1、3个月后, HMGB1、IL-32、MMP-9/TIMP-1水平降低率联合预测缓解的曲线下面积(AUC)分别为0.910、0.932, 其中治疗3个月后联合预测的AUC最大,差异有统计学意义(P < 0.05)。根据治疗3个月后ROC曲线分析的最佳截断值将患者分为高降低率亚组和低降低率亚组, HMGB1、IL-32、MMP-9/TIMP-1高降低率亚组患者病情进展率低于低降低率亚组,差异有统计学意义(P < 0.05)。
结论LN患者外周血HMGB1、IL-32、MMP-9/TIMP-1高水平变化与治疗应答、病情进展显著相关,治疗1、3个月后HMGB1、IL-32、MMP-9/TIMP-1联合预测LN患者治疗应答的价值较高。
Abstract:ObjectiveTo analyze the change in levels of high mobility group box 1 protein (HMGB1), interleukin-32 (IL-32), matrix metalloproteinase-9 (MMP-9)/tissue inhibitor of metalloproteinase-1 (TIMP-1) in peripheral blood of patients with lupus nephritis (LN) and their values in predicting prognosis.
MethodsA total of 86 patients with LN from October 2021 to June 2023 were selected and treated with induction therapy for 6 months. Based on remission status of the disease, patients were divided into remission group (n=66) and non-responder group (n=20). Baseline data, change in levels and reduction rates of HMGB1, IL-32 and MMP-9/TIMP-1, and the partial correlation of reduction rates of HMGB1, IL-32 and MMP-9/TIMP-1 levels in peripheral blood with treatment response as well as their predictive values for treatment response were compared between the two groups. Disease progression was compared between patients with different reduction rates of HMGB1, IL-32 and MMP-9/TIMP-1.
ResultsHMGB1, IL-32 and MMP-9/TIMP-1 levels in the remission group decreased significantly at 1 and 3 months after treatment compared to before treatment (P < 0.05); the levels of HMGB1, IL-32 and MMP-9/TIMP-1 in the remission group were significantly lower than those in the non-responder group at 1 and 3 months after treatment (P < 0.05); the reduction rates of HMGB1, IL-32 and MMP-9/TIMP-1 levels in the remission group were significantly higher than those in the non-responder group at 1 and 3 months after treatment (P < 0.05). Partial correlation analysis showed that the reduction rates of HMGB1, IL-32 and MMP-9/TIMP-1 levels were independently significantly correlated with treatment response (P < 0.05). One and three months after treatment, the values of the area under the curve (AUC) for the combined prediction of remission by the reduction rates of HMGB1, IL-32 and MMP-9/TIMP-1 levels were 0.910 and 0.932 respectively, with the AUC being the largest at 3 months after treatment (P < 0.05). Patients were divided into high and low reduction rate subgroups based on theoptimal cut-off value from the ROC curve analysis at 3 months after treatment, and the disease progression rate was significantly lower in the high reduction rate subgroup than in the low reduction rate subgroup for HMGB1, IL-32 and MMP-9/TIMP-1 (P < 0.05).
ConclusionThe great change in levels of HMGB1, IL-32 and MMP-9/TIMP-1 in peripheral blood of LN patients is significantly correlated with treatment response and disease progression, and the combined detections of HMGB1, IL-32 and MMP-9/TIMP-1 levels at 1 and 3 months after treatment have high value in predicting the treatment response of LN patients.
-
系统性红斑狼疮(SLE)是较为常见的自身免疫性疾病,多见于青年女性,常累及全身多个器官,是导致患者死亡的重要原因[1]。狼疮性肾炎(LN)是SLE的常见并发症,中国每年新确诊LN约158万例,病死率为25%~29%[2]。目前,临床治疗LN多采取糖皮质激素、免疫抑制剂药物治疗,部分患者经诱导治疗可获得部分缓解或完全缓解,但仍有部分患者治疗无反应,随疾病进展可能会出现全因死亡、终末期肾病等[3]。高迁移率族蛋白B1(HMGB1)、白细胞介素-32(IL-32) 均属于促炎细胞因子,具有活化单核细胞、中性粒细胞等功能, LN患者血清中HMGB1、IL-32呈高表达,与SLE活动度、预后不良密切相关,可介导参与LN疾病进展[4-5]。基质金属蛋白酶(MMP)-9、基质金属蛋白酶抑制剂(TIMP)-1均属于MMPs、TIMPs家族成员, MMPs与TIMPs的比值(MMPs/TIMPs)失衡可引起组织器官损害,导致细胞外基质过度降解或加重机体炎症反应,且MMP-9与TIMP-1的比值(MMP-9/TIMP-1)可参与LN疾病进展[6]。本研究探讨LN患者外周血HMGB1、IL-32、MMP-9/TIMP-1水平变化,分析其与治疗应答、疾病进展的关系,现报告如下。
1. 资料与方法
1.1 一般资料
纳入标准: (1) LN患者符合《中国狼疮肾炎诊断和治疗指南》[7]中的诊断标准: ①尿蛋白/肌酐>500 mg/g, 或24 h尿蛋白定量>0.5 g, 或随机尿检查尿蛋白呈(

根据纳入与排除标准,并采用回顾性研究设计选取2021年10月—2023年6月本院收治的86例LN患者为研究对象,其中男22例,女64例; 年龄18~58岁,平均(34.38±11.25)岁; 体质量指数22.3~25.3 kg/m2, 平均(23.78±0.75) kg/m2; 高血压6例,糖尿病9例,冠心病3例; 临床分型包括肾病综合征40例,孤立性血尿/蛋白尿24例,急性肾炎22例; 疾病严重程度包括轻度6例,中度32例,重度48例。本研究属于回顾性研究,不涉及知情同意,严格遵守《赫尔辛基宣言》,保护个人隐私权,研究数据仅限本研究使用。本研究已通过本院伦理委员会审批[院科伦审: (2021)伦审第(0022)号]。
1.2 方法
1.2.1 预后评估
86例LN患者参考《中国狼疮肾炎诊断和治疗指南》[7]诱导治疗6个月,根据不同病理类型选择合适的诱导治疗方案。Ⅰ型、Ⅱ型根据临床表现给予糖皮质激素和(或)免疫抑制剂(甲氨蝶呤、他克莫司),他克莫司维持血药浓度5~10 μg/L; Ⅲ型、Ⅳ型、Ⅴ型给予糖皮质激素联合免疫抑制剂。患者诱导治疗缓解后开始维持治疗,疗程至少3年,根据患者病情,调整糖皮质激素、免疫抑制剂剂量。
LN患者诱导治疗6个月后评估疗效[8]。①完全缓解: 24 h尿蛋白定量 < 0.5 g, 或尿蛋白/肌酐 < 500 mg/g, 无活动性尿沉渣,血清白蛋白≥35 g/L, 血肌酐正常或升高≤基础值的10%; ②部分缓解: 24 h尿蛋白定量 < 3.0 g, 尿蛋白下降较基线值降低≥50%, 血清白蛋白>30 g/L, 血肌酐升高≤基础值的10%。根据治疗情况的不同将患者分为缓解组(完全缓解和部分缓解)66例、无反应组(未达到完全缓解、部分缓解)20例。
1.2.2 基线资料
收集2组患者入组后年龄、冠心病、性别、糖尿病、体质量指数、病理分型、高血压、临床分型、有肾外表现(疲倦、乏力、发热、多汗、体质量降低等)、疾病活动度。疾病严重程度[7]采用SLE活动指数进行评估,总分105分, ≤4为无活动, 5~9分为轻度, 10~14分为中度, ≥15分为重度。
1.2.3 HMGB1、IL-32、MMP-9/TIMP-1
收集2组患者治疗前(入组时)以及治疗1、3个月后肘静脉血5 mL, 采用酶联免疫吸附法测定外周血HMGB1、IL-32、MMP-9、TIMP-1,并计算MMP-9/TIMP-1。
1.2.4 预后评估
统计所有患者病情进展情况,时间截至2024年6月,通过电话、住院及门诊病历等形式调查,包括死亡、终末期肾病[9]。
1.3 观察指标
① 比较2组基线资料、HMGB1、IL-32、MMP-9/TIMP-1。②分析外周血HMGB1、IL-32、MMP-9/TIMP-1降低率与治疗应答的偏相关性。③分析外周血HMGB1、IL-32、MMP-9/TIMP-1降低率预测治疗应答的价值。④比较不同HMGB1、IL-32、MMP-9/TIMP-1降低率患者的病情进展情况。
1.4 统计学方法
采用SPSS 27.0软件分析数据,计量资料呈正态分布、方差齐性时以(x±s)表示,比较行独立样本t检验; 计数资料以[n(%)]表示,比较行χ2检验,等级资料采用秩和检验; 采用重复测量方差分析外周血HMGB1、IL-32、MMP-9/TIMP-1水平变化,满足Mauchly′s球形检验采用方差分析,若时间与组别之间不存在交互效应,直接采用主效应检验分析; 采用多元回归进行偏相关性分析,采用受试者工作特征(ROC)曲线的曲线下面积(AUC)评估上述指标预测治疗应答的价值,采用K-M法绘制生存曲线,采用Log-rank检验进行组间比较。P < 0.05为差异有统计学意义。
2. 结果
2.1 2组基线资料比较
无反应组与缓解组年龄、性别、体质量指数、糖尿病、高血压、冠心病、临床分型、有肾外表现、病理分型、疾病活动度比较,差异均无统计学意义(P>0.05), 见表 1。
表 1 2组基线资料比较(x±s)[n(%)]基线资料 分类 无反应组(n=20) 缓解组(n=66) t/χ2 P 年龄/岁 35.68±11.01 33.99±10.84 0.609 0.544 性别 男 6(30.00) 16(24.24) 0.267 0.605 女 14(70.00) 50(75.76) 体质量指数/(kg/m2) 23.70±0.63 23.81±0.59 0.719 0.474 糖尿病 3(15.00) 6(9.09) 0.115 0.734 高血压 2(10.00) 4(6.06) 0.011 0.916 冠心病 1(5.00) 2(3.03) 0.076 0.783 临床分型 肾病综合征 9(45.00) 31(46.97) 0.755 0.450 孤立性血尿/蛋白尿 6(30.00) 18(27.27) 急性肾炎 5(25.00) 17(25.76) 病理分型 Ⅰ型 1(5.00) 2(3.03) 0.069 0.962 Ⅱ型 2(10.00) 8(12.12) Ⅲ型 7(35.00) 25(37.88) Ⅳ型 8(40.00) 27(40.91) Ⅴ型 2(10.00) 4(6.06) 有肾外表现 11(55.00) 32(48.48) 0.261 0.610 疾病活动度 轻度 2(10.00) 4(6.06) 0.777 0.678 中度 6(30.00) 26(39.39) 重度 12(60.00) 36(54.55) 2.2 2组外周血HMGB1、IL-32、MMP-9/TIMP-1比较
采用重复测量方差分析比较2组不同时点HMGB1、IL-32、MMP-9/TIMP-1水平,符合Mauchly′s球形检验要求(P>0.05), 组别与测量时间不存在交互作用(P>0.05), 分析主效应。时间主效应分析显示,无反应组治疗1、3个月后HMGB1、IL-32、MMP-9/TIMP-1水平降低,但差异无统计学意义(P>0.05); 缓解组治疗1、3个月后HMGB1、IL-32、MMP-9/TIMP-1水平较治疗前降低,差异有统计学意义(P < 0.05)。组别主效应分析显示,缓解组治疗1、3个月后HMGB1、IL-32、MMP-9/TIMP-1水平低于无反应组,差异有统计学意义(P < 0.05), 见表 2。缓解组治疗1、3个月后HMGB1、IL-32、MMP-9/TIMP-1水平降低率高于无反应组,差异有统计学意义(P < 0.05), 见表 3。
表 2 2组外周血HMGB1、IL-32、MMP-9/TIMP-1水平变化比较(x±s)指标 组别 n 治疗前 治疗1个月后 治疗3个月后 HMGB1/(μg/L) 无反应组 20 80.91±16.04 78.56±13.48# 76.85±15.29# 缓解组 66 82.83±14.60 69.04±10.71* 61.37±17.60* IL-32/(pg/mL) 无反应组 20 16.00±5.36 15.48±5.08# 15.26±4.99# 缓解组 66 15.79±5.21 8.63±2.71* 4.02±1.27* MMP-9/TIMP-1 无反应组 20 1.39±0.41 1.29±0.43# 1.23±0.40# 缓解组 66 1.42±0.45 1.01±0.33* 0.84±0.27* HMGB1: 高迁移率族蛋白B1; IL-32: 白细胞介素-32; MMP-9: 基质金属蛋白酶-9; TIMP-1: 基质金属蛋白酶抑制剂-1。
与治疗前比较, *P < 0.05; 与缓解组比较, #P < 0.05。表 3 2组外周血HMGB1、IL-32、MMP-9/TIMP-1水平降低率比较(x±s)% 组别 n HMGB1水平降低率 IL-32水平降低率 MMP-9/TIMP-1水平降低率 治疗1个月后 治疗3个月后 治疗1个月后 治疗3个月后 治疗1个月后 治疗3个月后 无反应组 20 2.90±0.94* 5.02±1.64* 3.25±1.04* 4.63±1.50* 7.19±2.35* 11.51±3.80* 缓解组 66 16.65±5.48 25.91±0.61 45.35±14.88 74.54±9.86 28.87±9.56 40.85±12.94 与缓解组比较, * P < 0.05。 2.3 外周血HMGB1、IL-32、MMP-9/TIMP-1水平降低率与治疗应答的偏相关性分析
偏相关性分析显示, HMGB1、IL-32、MMP-9/TIMP-1水平降低率与治疗应答独立相关(P < 0.001), 见表 4。
表 4 外周血HMGB1、IL-32、MMP-9/TIMP-1水平降低率与治疗应答的偏相关性分析变量 偏相关性系数 95%CI P HMGB1水平降低率 0.811 0.759~0.836 < 0.001 IL-32水平降低率 0.845 0.800~0.869 < 0.001 MMP-9/TIMP-1水平降低率 0.803 0.744~0.845 < 0.001 2.4 外周血HMGB1、IL-32、MMP-9/TIMP-1水平降低率预测治疗应答的价值
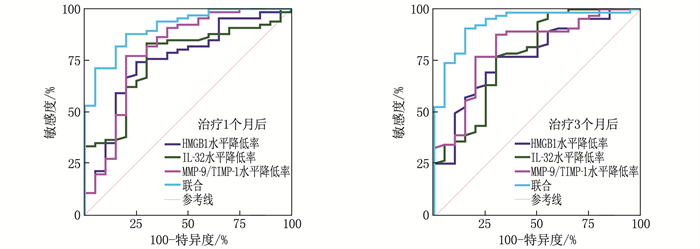
ROC曲线分析以缓解组为阳性样本,以无反应组为阴性样本。治疗1个月后, HMGB1、IL-32、MMP-9/TIMP-1水平降低率及3项联合预测缓解的AUC依次为0.753、0.755、0.798、0.910, 联合预测的AUC最大; 治疗3个月后, HMGB1、IL-32、MMP-9/TIMP-1水平降低率及3项联合预测缓解的AUC依次为0.772、0.778、0.814、0.932, 联合预测的AUC最大,见表 5、图 1。
表 5 外周血HMGB1、IL-32、MMP-9/TIMP-1水平降低率预测治疗应答的价值时点 指标 AUC 95%CI 最佳截断值/% 敏感度/% 特异度/% P 治疗1个月后 HMGB1水平降低率 0.753 0.648~0.839 6.34 74.24 75.00 < 0.001 IL-32水平降低率 0.755 0.650~0.841 14.69 83.33 70.00 < 0.001 MMP-9/TIMP-1水平降低率 0.798 0.697~0.877 10.95 77.27 80.00 < 0.001 联合 0.910 0.828~0.961 — 87.88 80.00 < 0.001 治疗3个月后 HMGB1水平降低率 0.772 0.669~0.856 12.41 77.27 70.00 < 0.001 IL-32水平降低率 0.778 0.675~0.860 34.94 77.27 70.00 < 0.001 MMP-9/TIMP-1水平降低率 0.814 0.715~0.889 17.78 87.88 70.00 < 0.001 联合 0.932 0.856~0.975 — 90.91 85.00 < 0.001 2.5 不同HMGB1、IL-32、MMP-9/TIMP-1降低率患者病情进展情况比较
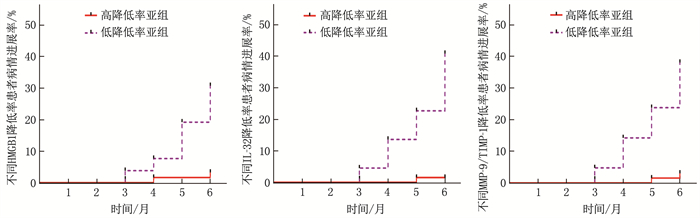
根据治疗3个月后ROC曲线分析的最佳截断值将患者分为HMGB1、IL-32、MMP-9/TIMP-1高降低率亚组和低降低率亚组, K-M曲线分析显示, HMGB1、IL-32、MMP-9/TIMP-1高降低率亚组患者病情进展率低于低降低率亚组,差异有统计学意义(P < 0.05), 见图 2。
3. 讨论
LN的临床表现主要为血尿、蛋白尿、管型尿及肾功能不全等,多数患者经过长时间系统治疗才能获得临床缓解,而小部分患者不能有效控制病情,随着疾病进展最终可出现全因死亡、终末期肾病等,是导致SLE死亡的重要原因[10]。肾活检穿刺是目前LN确诊和分类的“金标准”,但频繁的肾活检会加重患者的痛苦和经济负担,还可能增高并发症发生风险,不能作为LN长期的监测方法[11]。
HMGB1主要存在于细胞核中,可参与细胞分化、DNA修复、基因转录等,当HMGB1经循环系统释放至细胞外时,会发挥明显的促炎作用,不仅能直接充当炎症因子参与机体免疫应答,而且可作为内源性免疫佐剂激活抗原递呈细胞,启动适应性免疫应答过程,从而介导参与多种炎症疾病的发生和发展[12-13]。ZICKERT A等[14]研究显示, HMGB1在LN患者血清和尿液中高表达,且与SLE活动度呈正相关,患者经糖皮质激素或免疫抑制剂标准治疗后, HMGB1明显降低。本研究结果显示,无反应组治疗1、3个月后HMGB1无显著降低,而缓解组显著降低,且缓解组治疗1、3个月后HMGB1水平及降低率显著低于无反应组,说明HMGB1水平变化可反映LN患者病情进展程度。HMGB1在LN中的作用机制可能与肾小球系膜细胞过度增殖有关,张玮等[15]发现HMGB1表达在LN发病过程中呈上调趋势,过表达HMGB1可促进系膜细胞过度增生。FENG X J等[16]研究显示,抑制HMGB1能缓解LN系膜细胞外基质沉积,减轻系膜细胞肾损伤程度,有助于缓解LN进程。本研究中,部分LN患者经规范化治疗后病情缓解,肾损伤程度减轻, HMGB1水平降低。
IL-32是一种多功能细胞促炎性因子,主要位于16p13.3区域,在巨噬细胞、单核细胞、内皮细胞及上皮细胞中均有存在,能够诱导多种细胞因子和趋化因子释放,参与机体炎症反应,还可参与T细胞凋亡、宿主防御等,与多种炎症疾病的发展有关[17]。李莉等[18]研究显示, LN患者血清和尿液中IL-32高表达,与SLE活动度、肾功能指标有关, IL-32是LN患者活动期的危险因素。本研究中, IL-32水平趋势与HMGB1一致,提示IL-32与LN患者疾病进展有关,可能是因为患者病情缓解提示肾损伤程度减轻,可进一步抑制IL-32等促炎因子和介质的产生。MMP-9是一种明胶酶,在生理病理条件下,可降解细胞外基质(ECM)中的纤维连接蛋白和胶原,还能参与细胞增殖、分化、黏附、迁移及炎症反应等过程[19-20]。正常肾小球ECM位于肾小球毛细血管基膜和系膜,含量较为丰富的是胶原蛋白Ⅳ,而MMP-9活性激活或过度表达可抑制ECM合成和降解,直接导致肾小球间质纤维化和肾功能降低,可见MMP-9在肾纤维化和间质化中发挥重要作用[21-22]。TIMP-1是MMPs特异性抑制剂,在巨噬细胞和结缔组织细胞中分泌产生, MMP-9/TIMP-1失衡会影响机体的部分生理功能,如ECM稳态失衡、肾小球基底膜重塑等,导致ECM堆积,引起肾脏纤维化[23]。
本研究结果显示,缓解组治疗1、3个月后MMP-9/TIMP-1较治疗前显著降低,而无反应组则无明显变化,且缓解组治疗1、3个月后MMP-9/TIMP-1水平低于无反应组(P < 0.05)、下降率高于无反应组(P < 0.05), 提示MMP-9/TIMP-1与LN治疗应答有关。分析原因为: ① MMP-9/TIMP-1失衡导致机体ECM过度堆积在肾脏[24],可加重病情,影响疗效; ② MMP-9/TIMP-1失衡与机体炎症反应有关,能诱导炎性损伤[25], 影响治疗效果。本研究进一步分析显示, HMGB1、IL-32、MMP-9/TIMP-1水平降低率与治疗应答呈独立相关, ROC曲线显示治疗1、3个月后HMGB1、IL-32、MMP-9/TIMP-1水平降低率联合预测缓解的AUC分别为0.910、0.932, 且治疗3个月后联合预测价值更高; 治疗3个月后,根据ROC曲线分析的最佳截断值将患者分为高降低率亚组和低降低率亚组, HMGB1、IL-32、MMP-9/TIMP-1高降低率亚组患者病情进展率低于低降低率亚组,提示HMGB1、IL-32、MMP-9/TIMP-1可用于评估患者病情进展。
综上所述, LN患者外周血HMGB1、IL-32、MMP-9/TIMP-1高水平与治疗应答、病情进展存在关联,治疗1、3个月后HMGB1、IL-32、MMP-9/TIMP-1联合预测LN患者治疗应答的价值较高,其中治疗3个月后预测价值更高,可为临床诊治LN提供参考。
-
表 1 2组基线资料比较(x±s)[n(%)]
基线资料 分类 无反应组(n=20) 缓解组(n=66) t/χ2 P 年龄/岁 35.68±11.01 33.99±10.84 0.609 0.544 性别 男 6(30.00) 16(24.24) 0.267 0.605 女 14(70.00) 50(75.76) 体质量指数/(kg/m2) 23.70±0.63 23.81±0.59 0.719 0.474 糖尿病 3(15.00) 6(9.09) 0.115 0.734 高血压 2(10.00) 4(6.06) 0.011 0.916 冠心病 1(5.00) 2(3.03) 0.076 0.783 临床分型 肾病综合征 9(45.00) 31(46.97) 0.755 0.450 孤立性血尿/蛋白尿 6(30.00) 18(27.27) 急性肾炎 5(25.00) 17(25.76) 病理分型 Ⅰ型 1(5.00) 2(3.03) 0.069 0.962 Ⅱ型 2(10.00) 8(12.12) Ⅲ型 7(35.00) 25(37.88) Ⅳ型 8(40.00) 27(40.91) Ⅴ型 2(10.00) 4(6.06) 有肾外表现 11(55.00) 32(48.48) 0.261 0.610 疾病活动度 轻度 2(10.00) 4(6.06) 0.777 0.678 中度 6(30.00) 26(39.39) 重度 12(60.00) 36(54.55) 表 2 2组外周血HMGB1、IL-32、MMP-9/TIMP-1水平变化比较(x±s)
指标 组别 n 治疗前 治疗1个月后 治疗3个月后 HMGB1/(μg/L) 无反应组 20 80.91±16.04 78.56±13.48# 76.85±15.29# 缓解组 66 82.83±14.60 69.04±10.71* 61.37±17.60* IL-32/(pg/mL) 无反应组 20 16.00±5.36 15.48±5.08# 15.26±4.99# 缓解组 66 15.79±5.21 8.63±2.71* 4.02±1.27* MMP-9/TIMP-1 无反应组 20 1.39±0.41 1.29±0.43# 1.23±0.40# 缓解组 66 1.42±0.45 1.01±0.33* 0.84±0.27* HMGB1: 高迁移率族蛋白B1; IL-32: 白细胞介素-32; MMP-9: 基质金属蛋白酶-9; TIMP-1: 基质金属蛋白酶抑制剂-1。
与治疗前比较, *P < 0.05; 与缓解组比较, #P < 0.05。表 3 2组外周血HMGB1、IL-32、MMP-9/TIMP-1水平降低率比较(x±s)
% 组别 n HMGB1水平降低率 IL-32水平降低率 MMP-9/TIMP-1水平降低率 治疗1个月后 治疗3个月后 治疗1个月后 治疗3个月后 治疗1个月后 治疗3个月后 无反应组 20 2.90±0.94* 5.02±1.64* 3.25±1.04* 4.63±1.50* 7.19±2.35* 11.51±3.80* 缓解组 66 16.65±5.48 25.91±0.61 45.35±14.88 74.54±9.86 28.87±9.56 40.85±12.94 与缓解组比较, * P < 0.05。 表 4 外周血HMGB1、IL-32、MMP-9/TIMP-1水平降低率与治疗应答的偏相关性分析
变量 偏相关性系数 95%CI P HMGB1水平降低率 0.811 0.759~0.836 < 0.001 IL-32水平降低率 0.845 0.800~0.869 < 0.001 MMP-9/TIMP-1水平降低率 0.803 0.744~0.845 < 0.001 表 5 外周血HMGB1、IL-32、MMP-9/TIMP-1水平降低率预测治疗应答的价值
时点 指标 AUC 95%CI 最佳截断值/% 敏感度/% 特异度/% P 治疗1个月后 HMGB1水平降低率 0.753 0.648~0.839 6.34 74.24 75.00 < 0.001 IL-32水平降低率 0.755 0.650~0.841 14.69 83.33 70.00 < 0.001 MMP-9/TIMP-1水平降低率 0.798 0.697~0.877 10.95 77.27 80.00 < 0.001 联合 0.910 0.828~0.961 — 87.88 80.00 < 0.001 治疗3个月后 HMGB1水平降低率 0.772 0.669~0.856 12.41 77.27 70.00 < 0.001 IL-32水平降低率 0.778 0.675~0.860 34.94 77.27 70.00 < 0.001 MMP-9/TIMP-1水平降低率 0.814 0.715~0.889 17.78 87.88 70.00 < 0.001 联合 0.932 0.856~0.975 — 90.91 85.00 < 0.001 -
[1] 鲍星兰, 王丹丹, 靳子义, 等. 脐带间充质干细胞移植治疗难治性狼疮性肾炎的远期预后分析[J]. 实用临床医药杂志, 2023, 27(10): 1-5, 20. doi: 10.7619/jcmp.20230609 [2] 陈刚, 王小芳. 脂代谢紊乱与系统性红斑狼疮相关性研究[J]. 中华实用诊断与治疗杂志, 2017, 31(6): 554-555. [3] MOK C C, ONNO TENG Y K O, SAXENA R, et al. Treatment of lupus nephritis: consensus, evidence and perspectives[J]. Nat Rev Rheumatol, 2023, 19(4): 227-238. doi: 10.1038/s41584-023-00925-5
[4] HISHAM F A, THARWAT S, SAMRA N E, et al. High mobility group box protein 1 (HMGB1) serum and urinary levels and gene polymorphism in Egyptian patients with systemic lupus erythematosus: a possible relation to lupus nephritis[J]. Lupus, 2022, 31(14): 1777-1785. doi: 10.1177/09612033221132484
[5] 丁昕宇, 李平, 白羽, 等. 狼疮性肾炎患者血清白细胞介素-32及肾损伤分子-1水平变化[J]. 中华实用诊断与治疗杂志, 2020, 34(1): 48-51. [6] 唐莉, 王鹏军, 曹李娜, 等. 狼疮性肾炎患者血清中基质金属蛋白酶-9、基质金属蛋白酶抑制因子-1的表达水平及其意义[J]. 广西医学, 2018, 40(22): 2688-2691. [7] 中国狼疮肾炎诊断和治疗指南编写组. 中国狼疮肾炎诊断和治疗指南[J]. 中华医学杂志, 2019, 99(44): 3441-3455. doi: 10.3760/cma.j.issn.0376-2491.2019.44.001 [8] 高丹, 路漫漫. 狼疮性肾炎患者临床病理特征及远期预后影响因素分析[J]. 中华实用诊断与治疗杂志, 2022, 36(1): 59-63. [9] 张国珍, 徐志泉, 周朝艾, 等. 儿童狼疮性肾炎46例临床特点及治疗随访观察[J]. 中国医学前沿杂志: 电子版, 2018, 10(8): 26-29. [10] 边彩月, 秦艺璐, 梁舒, 等. 血清和尿液联合检测免疫球蛋白结合蛋白1在狼疮性肾炎中的预测价值[J]. 实用临床医药杂志, 2024, 28(10): 83-86, 95. doi: 10.7619/jcmp.20233945 [11] LAKSHMI V R, VANGALA N, UPPIN M S, et al. Revisiting vasculopathy in lupus nephritis: a renal biopsy evaluation study[J]. Indian J Nephrol, 2022, 32(1): 28-33. doi: 10.4103/ijn.IJN_131_20
[12] LI S J, RUAN D D, WU W Z, et al. Potential regulatory role of the Nrf2/HMGB1/TLR4/NF-κB signaling pathway in lupus nephritis[J]. Pediatr Rheumatol Online J, 2023, 21(1): 130.
[13] SHEN J, ZHANG M Y, PENG M Y. Progress of exosome research in systemic lupus erythematosus[J]. Cytokine X, 2022, 4(2/3): 100066.
[14] ZICKERT A, PALMBLAD K, SUNDELIN B, et al. Renal expression and serum levels of high mobility group box 1 protein in lupus nephritis[J]. Arthritis Res Ther, 2012, 14(1): R36. http://www.researchgate.net/profile/Kevin_Tracey/publication/221845972_Renal_expression_and_serum_levels_of_high_mobility_group_box_1_protein_in_lupus_nephritis/links/0fcfd50868f9410944000000
[15] 张玮, 杨冉, 郭惠芳, 等. HMGB1和TNFAIP3在狼疮性肾炎系膜细胞增殖中的作用[J]. 中国药理学通报, 2017, 33(8): 1109-1113. [16] FENG X J, YANG R, TIAN Y X, et al. HMGB1 protein promotes glomerular mesangial matrix deposition via TLR2 in lupus nephritis[J]. J Cell Physiol, 2020, 235(6): 5111-5119. http://pubmed.ncbi.nlm.nih.gov/31667864/
[17] ADAWY A, LI L B, HIRAO H, et al. Potential involvement of IL-32 in cell-to-cell communication between macrophages and hepatoblastoma[J]. Pediatr Surg Int, 2023, 39(1): 275.
[18] 李莉, 张老追, 李玲玲, 等. 狼疮性肾炎患者血清和尿液中IL-32和KIM-1的表达水平及临床意义[J]. 河北医药, 2019, 41(3): 361-364, 369. [19] BONADIO A, OGUCHE S, LAVY T, et al. Computational design of matrix metalloprotenaise-9 (MMP-9) resistant to auto-cleavage[J]. Biochem J, 2023, 480(14): 1097-1107. http://www.semanticscholar.org/paper/5a3cadaecc2338b5a1ac95f201cb406b26b8a599
[20] ENE C D, NICOLAE I. The inflammatory profile orchestrated by inducible nitric oxide synthase in systemic lupus erythematosus[J]. J Pers Med, 2023, 13(6): 934.
[21] HASSAN N H, YOUSEF D M, ALSEMEH A E. Hesperidin protects against aluminum-induced renal injury in rats via modulating MMP-9 and apoptosis: biochemical, histological, and ultrastructural study[J]. Environ Sci Pollut Res Int, 2023, 30(13): 36208-36227. doi: 10.1007/s11356-022-24800-0
[22] NTRINIAS T, PAPASOTIRIOU M, BALTA L, et al. Biomarkers in progressive chronic kidney disease. still a long way to go[J]. Pril, 2019, 40(3): 27-39. http://pubmed.ncbi.nlm.nih.gov/32109222/
[23] YAMAKOSHI S, NAKAMURA T, MORI N, et al. Effects of exercise training on renal interstitial fibrosis and renin-angiotensin system in rats with chronic renal failure[J]. J Hypertens, 2021, 39(1): 143-152. http://pubmed.ncbi.nlm.nih.gov/32833922/
[24] BAUVOIS B, MOTHU N, NGUYEN J, et al. Specific changes in plasma concentrations of matrix metalloproteinase-2 and-9, TIMP-1 and TGF-beta1 in patients with distinct types of primary glomerulonephritis[J]. Nephrol Dial Transplant, 2007, 22(4): 1115-1122. http://europepmc.org/abstract/MED/17205957
[25] DO VALLE G T, RICCI S T, SILVA A O, et al. Ethanol consumption increases renal dysfunction and mortality in a mice model of sub-lethal sepsis[J]. Can J Physiol Pharmacol, 2021, 99(7): 699-707. http://www.xueshufan.com/publication/3113136266




 下载:
下载:
 苏公网安备 32100302010246号
苏公网安备 32100302010246号
