Impacts of salidroside on mitochondrial autophagy in ischemiccardiomyopathy rats by regulating the PINK1/Parkin signaling pathway
-
摘要:目的
探讨红景天苷(Sal)调节PTEN诱导激酶1(PINK1)/E3泛素连接酶(Parkin)信号通路对缺血性心肌病(ICM)大鼠线粒体自噬的影响。
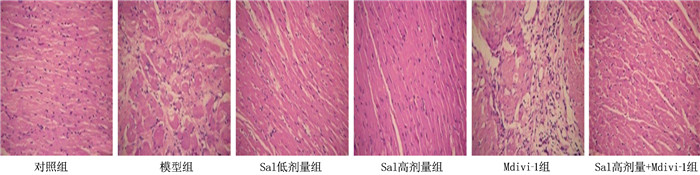
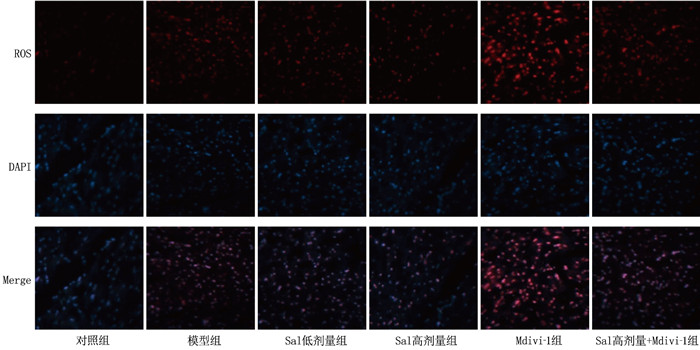
方法将30只SD大鼠随机分为对照组、模型组、Sal低剂量组、Sal高剂量组、线粒体自噬抑制剂(Mdivi-1)组和Sal高剂量+Mdivi-1组,每组5只。构建ICM大鼠模型。分析各组大鼠左室射血分数(LVEF)、左室缩短分数(LVFS)、左室舒张末期内径(LVIDd)和左室收缩末期内径(LVIDs)。采用酶联免疫吸附测定(ELISA)检测各组大鼠血清乳酸脱氢酶(LDH)、肌钙蛋白I(cTnI)、肌酸激酶同工酶(CK)、N末端B型利钠肽原(NT-proBNP)水平。采用苏木素-伊红(HE)染色观察各组大鼠心肌组织病理变化,采用透射电子显微镜观察心肌组织线粒体结构。测定各组大鼠活性氧(ROS)、丙二醛(MDA)、超氧化物歧化酶(SOD)水平。采用蛋白质免疫印迹(Western blot)检测心肌组织微管相关蛋白轻链3(LC3)、肌球蛋白样Bcl-2结合蛋白(Beclin1)、泛素结合蛋白(p62)、PINK1、Parkin蛋白的表达水平。
结果与对照组比较,模型组心肌组织病理损伤加重,线粒体损伤明显。模型组LVEF、LVFS、SOD、p62水平低于对照组, LVIDd、LVIDs、LDH、cTnI、CK、NT-proBNP、ROS、MDA、LC3Ⅱ/LC3Ⅰ、Beclin1、PINK1、Parkin水平高于对照组,差异有统计学意义(P < 0.05)。与模型组比较, Sal低剂量组、Sal高剂量组心肌组织损伤和线粒体损伤减轻。Sal低剂量组、Sal高剂量组LVEF、LVFS、SOD、LC3Ⅱ/LC3Ⅰ、Beclin1、PINK1、Parkin水平高于模型组, LVIDd、LVIDs、LDH、cTnI、CK、NT-proBNP、ROS、MDA、p62水平低于模型组,差异有统计学意义(P < 0.05)。与模型组比较, Mdivi-1组心肌组织病理损伤加重,线粒体损伤明显。Mdivi-1组LVEF、LVFS、SOD、LC3Ⅱ/LC3Ⅰ、Beclin1、PINK1、Parkin水平低于模型组, LVIDd、LVIDs、LDH、cTnI、CK、NT-proBNP、ROS、MDA、p62水平高于模型组,差异有统计学意义(P < 0.05)。与Sal低剂量组比较, Sal高剂量组心肌组织损伤改善,线粒体损伤减轻。Sal高剂量组LVEF、LVFS、SOD、LC3Ⅱ/LC3Ⅰ、Beclin1、PINK1、Parkin水平高于Sal低剂量组, LVIDd、LVIDs、LDH、cTnI、CK、NT-proBNP、ROS、MDA、p62水平低于Sal低剂量组,差异有统计学意义(P < 0.05)。Mdivi-1可显著抑制线粒体自噬,并抑制Sal对心肌组织PINK1/Parkin信号通路的激活和心功能的改善(P < 0.05)。
结论Sal可能通过激活PINK1/Parkin信号通路,促进ICM大鼠线粒体自噬,进而改善大鼠心肌损伤。
Abstract:ObjectiveTo investigate the effects of salidroside (Sal) on mitochondrial autophagy in ischemic cardiomyopathy (ICM) rats by modulating the PTEN-induced kinase 1 (PINK1)/E3 ubiquitin ligase (Parkin) signaling pathway.
MethodsThirty SD rats were randomly divided into control group, model group, low-dose Sal group, high-dose Sal group, mitochondrial autophagy inhibitor (Mdivi-1) group and high-dose Sal + Mdivi-1 group, with five rats in each group. The ICM rat model was established. The left ventricular ejection fraction (LVEF), left ventricular fractional shortening (LVFS), left ventricular end-diastolic diameter (LVIDd) and left ventricular end-systolic diameters (LVIDs) were analyzed. Enzyme-linked immunosorbent assay (ELISA) was used to detect serum levels of lactate dehydrogenase (LDH), cardiac troponin I (cTnI), creatine kinase (CK) and N-terminal pro-brain natriuretic peptide (NT-proBNP). Hematoxylin and eosin (HE) staining was performed to observe pathological changes in myocardial tissue, and transmission electron microscopy was used to examine mitochondrial structure. The levels of reactive oxygen species (ROS), malondialdehyde (MDA) and superoxide dismutase (SOD) were measured. Western blot analysis was conducted to determine the expression levels of microtubule-associated protein light chain 3 (LC3), Beclin1, p62, PINK1 and Parkin in myocardial tissue.
ResultsCompared with the control group, the model group showed more severe myocardial tissue and mitochondrial damage. The LVEF, LVFS, SOD and p62 levels in the model group were significantly lower than those in the control group, while the LVIDd, LVIDs, LDH, cTnI, CK, NT-proBNP, ROS, MDA, LC3II/LC3I, Beclin1, PINK1 and Parkin levels were significantly higher (P < 0.05). Compared with the model group, the low-dose and high-dose Sal groups exhibited reduced myocardial and mitochondrial damage. The LVEF, LVFS, SOD, LC3II/LC3I, Beclin1, PINK1 and Parkin levels in the low-dose and high-dose Sal groups were significantly higher than those in the model group, while the LVIDd, LVIDs, LDH, cTnI, CK, NT-proBNP, ROS, MDA and p62 levels were significantly lower (P < 0.05). Compared with the model group, the Mdivi-1 group showed more severe myocardial and mitochondrial damage. The LVEF, LVFS, SOD, LC3II/LC3I, Beclin1, PINK1 and Parkin levels in the Mdivi-1 group were significantly lower than those in the model group, while the LVIDd, LVIDs, LDH, cTnI, CK, NT-proBNP, ROS, MDA and p62 levels were significantly higher (P < 0.05). Compared with the low-dose Sal group, the high-dose Sal group demonstrated further improvement in myocardial and mitochondrial damage. The LVEF, LVFS, SOD, LC3II/LC3I, Beclin1, PINK1 and Parkin levels in the high-dose Sal group were significantly higher than those in the low-dose Sal group, while the LVIDd, LVIDs, LDH, cTnI, CK, NT-proBNP, ROS, MDA and p62 levels were significantly lower (P < 0.05). Mdivi-1 significantly inhibited mitochondrial autophagy and suppressed the activation of the PINK1/Parkin signaling pathway and the improvement in cardiac function induced by Sal (P < 0.05).
ConclusionSal may improve myocardial injury in ICM rats by activating the PINK1/Parkin signaling pathway and promoting mitochondrial autophagy.
-
卵圆孔未闭是一种先天性心脏病,在成年人群中发病率为35%[1], 可引起脑血管疾病。心房颤动(房颤)是一种心脏无序颤动的表现,老年人发病率可达10%以上[2]。当出现房颤时,患者的左心耳收缩功能、排空速度均会出现异常,导致血流速度缓慢,引起左心耳血栓。血栓脱落后会到达左房,由左房到达左室,并随着动脉血到主动脉及其分支,进而引发多种脑栓塞性疾病,威胁患者生命安全[3-4]。卵圆孔未闭合并房颤患者的心脑血管疾病发生风险较高,需及时诊断并治疗。经食道超声心动图是一种通过将超声探头置于食管内进行检查的方法,探头紧邻心脏和近心大血管,检查时能够获得较为清晰的图像,其临床诊断正确率较高[5]。本研究采用食管超声心动图对卵圆孔未闭合并房颤患者进行检查,评估其左心耳容积及功能的变化,现报告如下。
1. 资料与方法
1.1 一般资料
选取2020年12月—2022年12月就诊的80例卵圆孔未闭患者作为研究对象,根据是否合并房颤分为房颤组(n=44)和非房颤组(n=36)。纳入标准: ①知情同意本研究者; ②年龄≤75岁者; ③临床诊断为卵圆孔未闭合[6]者; ④临床表现与健康人群无显著差异者。排除标准: ①伴严重心脏瓣膜病、心肌病及心律失常者; ②中度及以上肺动脉高压者; ③有食管静脉曲张、食管狭窄畸形等上消化道疾病者; ④先天性心脏病患者; ⑤持续咳嗽不适行食道超声心动图检查者; ⑥严重脏器功能不全患者; ⑦有食管手术或纵隔放射治疗史患者。另选取同期检查的健康人群30例作为对照组。本研究通过伦理委员会审核。
1.2 方法
1.2.1 采集图像
采用GE飞利浦EPIQ 7C彩色多普勒超声诊断仪,(经胸探头型号M5S, 频率为1.7~3.5 MHz; 经食道探头型号6VT, 频率为2.0~7.0 MHz), 仪器内配备有EchoPAC图像处理分析软件。先行常规的经胸超声心动图检查,将探头放于胸骨旁,调整探头角度,显示左心耳长轴切面及左心耳口横切面,在左心耳长轴切面及左心耳口横切面测量左房内径(LAD)水平。然后再对患者进行经食道超声心动图检查,首先嘱咐患者口服10 mL盐酸达克罗宁胶浆对口咽部黏膜局部麻醉。采用经食道超声探头插于食管中段,深度约为30 cm, 旋转180°获得完整连续的扫描图像,清晰显示左心耳二维结构后,储存左心耳二维图像待分析,然后启动3D ZOOM, 使2个互相垂直的二维图像完全包括左房耳目标区域,然后再次启动3D ZOOM获取左心耳的三维图像,并存取实时三维动态图像[7](图 1)。
1.2.2 分析图像
打开所有患者经食道超声心动图检查所得的三维动态图像,进行逐帧回放,导出数据后采用Qlab对左心耳相关参数进行分析计算,包括左心耳最大容积(LAAVmax)、左心耳最小容积(LAAVmin)、左心耳开口最大面积(MA)、左心耳开口最大长径(MD)、左心耳最大排空速度(LAAeV)及左心耳最大充盈速度(LAAfV)[8]。
1.3 观察指标
① 记录3组常规经胸超声心动图检查测得的LAD水平。②评估3组左心耳内有无自发显影(SEC)和血栓形成情况, SEC严重程度和血栓形成的判定标准参考相关文献[9]。③比较3组左心耳容积及功能相关参数水平。④对患者进行为期12个月的随访,记录随访期间主要终点事件和次要终点事件的发生情况。
1.4 统计学分析
采用SPSS 20.0软件分析数据,计量资料均符合正态分布,以(x±s)表示。房颤组与非房颤组组间比较采用独立样本t检验,多组间比较采用单因素方差分析,进一步两两比较采用LSD-t检验; 计数资料以[n(%)]表示,行χ2检验。检验标准α=0.05。P < 0.05为差异有统计学意义。
2. 结果
2.1 3组基线资料比较
3组患者基线资料比较,差异无统计学意义(P>0.05); 房颤组患者的LAD大于非房颤组和对照组,差异有统计学意义(P < 0.05); 非房颤组患者的LAD与对照组比较,差异无统计学意义(P>0.05), 见表 1。
表 1 3组基线资料比较(x±s)[n(%)]基线资料 房颤组(n=44) 非房颤组(n=36) 对照组(n=30) Z/F P 性别 男 26(59.09) 22(61.11) 18(60.00) 0.030 0.854 女 18(40.91) 14(38.89) 12(40.00) 年龄/岁 61.94±7.94 62.08±8.06 62.17±8.02 0.008 0.992 体质量指数/(kg/m2) 21.63±1.43 21.58±1.44 21.53±1.49 0.043 0.958 吸烟史 22(50.00) 19(52.78) 12(40.00) 1.170 0.280 饮酒史 25(56.82) 17(47.22) 13(43.33) 1.460 0.227 左房内径/mm 41.35±3.55 34.40±0.35 34.36±0.38 124.607 < 0.001 2.2 3组左心耳SEC严重程度比较
房颤组、非房颤组SEC严重患者占比高于对照组,差异有统计学意义(P < 0.05)。房颤组SEC严重程度分布情况与非房颤组相比,差异无统计学意义(P>0.05), 见表 2。
表 2 3组左心耳SEC严重程度比较[n(%)]严重程度 房颤组(n=44) 非房颤组(n=36) 对照组(n=30) Z P 无 29(65.91) 28(77.78) 30(100.00) 14.420 0.006 轻度 4(9.09) 2(5.56) 0 中度 5(11.36) 4(11.11) 0 重度 4(9.09) 2(5.56) 0 血栓形成 2(4.55) 0 0 2.3 3组左心耳容积及功能相关参数比较
与对照组相比,房颤组患者及非房颤组患者LAAVmax、LAAVmin、左心耳开口MA、左心耳开口MD均增大, LAAeV及LAAfV均减小,差异有统计学意义(P < 0.05); 房颤组患者的LAAVmax、LAAVmin、左心耳开口MA、左心耳开口MD均大于非房颤组, LAAeV及LAAfV均小于非房颤组,差异有统计学意义(P < 0.05), 见表 3。
表 3 3组左心耳容积及功能相关参数比较(x±s)参数 房颤组(n=44) 非房颤组(n=36) 对照组(n=30) F P LAAVmax/mL 7.73±2.37*# 5.46±1.54* 3.57±1.03 47.724 < 0.001 LAAVmin/mL 5.24±1.68*# 3.12±0.93* 1.73±0.52 77.672 < 0.001 左心耳开口MA/mm2 6.35±1.68*# 4.61±1.33* 2.97±0.89 53.721 < 0.001 左心耳开口MD/mm 3.91±0.59*# 3.57±0.57* 3.03±0.43 22.323 < 0.001 LAAeV/(m/s) 0.15±0.04*# 0.41±0.13* 0.72±0.14 253.230 < 0.001 LAAfV/(m/s) 0.22±0.07*# 0.51±0.15* 0.68±0.10 167.535 < 0.001 LAAVmax: 左心耳最大容积; LAAVmin: 左心耳最小容积; MA: 最大面积; MD: 最大长径; LAAeV: 左心耳最大排空速度; LAAfV: 左心耳最大充盈速度。与对照组比较, * P < 0.05; 与非房颤组比较, #P < 0.05。 2.4 SEC患者左心耳容积及功能相关参数比较
与房颤组SEC患者相比,非房颤组SEC患者的LAAVmax、LAAVmin、左心耳开口MA、左心耳开口MD较小, LAAeV及LAAfV较大,差异有统计学意义(P < 0.05), 见表 4。
表 4 房颤组与非房颤组SEC患者的左心耳容积及功能相关参数比较(x±s)参数 房颤组(n=15) 非房颤组(n=8) LAAVmax/mL 7.86±1.82* 6.05±1.03 LAAVmin/mL 5.52±1.71* 3.53±0.52 左心耳开口MA/mm2 6.64±1.83* 4.47±0.89 左心耳开口MD/mm 4.16±0.75* 3.71±0.43 LAAeV/(m/s) 0.13±0.03* 0.29±0.14 LAAfV/(m/s) 0.20±0.06* 0.47±0.10 与非房颤组比较, * P < 0.05。 2.5 预后情况
房颤组与非房颤组经卵圆孔未闭封堵术的手术成功率均为100.00%。治疗后,房颤组总终点事件发生率高于非房颤组,差异有统计学意义(P < 0.05), 见表 5。
表 5 房颤组与非房颤组预后情况比较[n(%)]预后 分类 房颤组(n=44) 非房颤组(n=36) 主要终点事件 卒中 3(6.82) 1(2.78) 死亡 1(2.27) 0 血管栓塞 1(2.27) 0 次要终点事件 新发房颤 4(9.09) 2(5.56) 心肌梗死 1(2.27) 1(2.78) 再次住院 2(4.55) 0 出血 3(6.82) 1(2.78) 总终点事件 15(34.09)* 5(13.89) 与非房颤组比较, * P < 0.05。 3. 讨论
卵圆孔是胎儿在胚胎发育时期心脏的一个重要结构,正常情况下,其在出生后会自动闭合,但研究[10]发现, 20%~25%的成年人卵圆孔不完全闭合。房颤是一种心脏发生不规则快速小幅颤动的表现,其是心脏内血栓形成和脑卒中发生的主要原因,与常规窦性心律患者相比,房颤患者发生缺血性脑卒中的风险更高[11-12]。
左心耳是左心房右前方向突出的部分,主要用于容纳、缓冲和调节心房内血液流动。左心耳内存在凹凸不平的肌小梁,容易使得血流产生旋涡和流速减慢,因此其也是左心房内血栓的好发部位。相关文献[13-14]报道,房颤导致中风的血栓, 90%以上源于左心耳。左心耳大部分被左心房遮挡,常规的经胸心脏超声心动图虽可以较好显示左心房结构,但对于左心耳容积和结构的改变不是很敏感[15]。左心耳与食管近邻,可通过将超声探头放置于食道内观察,进行经食道心脏超声检查。
本研究结果显示,房颤组患者的LAD较非房颤组患者及对照组显著增大,而非房颤组患者与对照组比较无显著差异。分析原因为,当房颤发生时,血液处于瘀滞状态,导致左心房内压力升高,左心耳通过增加内径来缓解压力,以保证左心室血量充盈。相关研究[16]表示,并非所有的卵圆孔未闭均会导致LAD增大,但当患者出现LAD增大时,预示着其合并房颤的风险增加。本研究结果显示,房颤组患者及非房颤组患者SEC程度较为严重,且检查出房颤组出现2例血栓形成患者。当卵圆孔未闭时,左心耳因具有正常收缩功能,极少形成血栓,但患者左心房内的收缩功能降低,血流排空速度下降,进而出现自发性显影。当合并房颤时,左心房及左心耳均会失去正常的收缩功能,加之左心耳表面结构特殊,血流速度减缓,导致血液瘀滞,从而形成血栓[17]。而本研究中房颤组与非房颤组的SEC严重程度无显著差异,可能与本研究纳入样本量较小有关。本研究对3组左心耳开口MD、MA及左心耳容积相关参数进行检查分析,结果提示,卵圆孔未闭合并房颤会使左心耳开口MA及容积增大,降低左心耳排空功能,这与陈静婉等[18]研究结果一致。卵圆孔未闭会导致左心房内压力增大,为了保证左心室血液充盈,左心房及左心耳内径也会随之增大,加强收缩功能,缓解左心室压力,进而充盈及排空速度降低。合并房颤时,左心耳开口会显著增宽,形状结构会发生改变,左心耳容积也随之增大。但此时左心耳已失去正常收缩功能,左心壁的内向运动难以足够排空左心耳,因此其充盈及排空速度逐渐降低。此外本研究中,房颤组患者和非房颤组经卵圆孔未闭封堵术的手术成功率均为100.00%, 房颤组总终点事件发生率显著高于非房颤组。由此提示,经食道超声心动图检查对卵圆孔未闭合并房颤患者具有良好的诊断价值,能够评估患者预后情况。
综上所述,对卵圆孔未闭合并房颤患者行食道超声心动图检查可清晰观察其左心耳生理结构,可更加准确地评估左心耳容积及功能改变。
-
表 1 各组大鼠心功能指标比较(x±s)
组别 n LVEF/% LVFS/% LVIDd/mm LVIDs/mm 对照组 5 81.35±5.37 62.84±3.91 3.85±0.47 2.94±0.40 模型组 5 51.82±3.25* 40.05±2.37* 6.28±0.75* 5.36±0.68* Sal低剂量组 5 65.19±4.48# 49.47±2.15# 5.31±0.69# 4.31±0.55# Sal高剂量组 5 78.46±4.75#△ 58.93±2.96#△ 4.29±0.52#△ 3.49±0.44#△ Mdivi-1组 5 42.07±2.39# 32.48±2.85# 7.96±0.85# 6.83±0.71# Sal高剂量+Mdivi-1组 5 57.93±3.58▲ 37.06±3.16▲ 6.30±0.82▲ 5.17±0.61▲ LVEF: 左室射血分数; LVFS: 左室缩短分数; LVIDd: 左室舒张末期内径; LVIDs: 左室收缩末期内径。
与对照组相比, *P < 0.05;与模型组相比, #P < 0.05; 与Sal低剂量组相比, △P < 0.05; 与Sal高剂量组相比, ▲P < 0.05。表 2 各组大鼠心肌损伤标志物比较(x±s)
组别 n LDH/(U/mL) cTnI/(pg/mL) CK/(U/L) NT-proBNP/(pg/mL) 对照组 5 3.19±0.48 45.81±5.26 72.39±8.15 68.74±6.31 模型组 5 18.36±1.95* 136.42±15.73* 168.35±17.91* 135.26±12.43* Sal低剂量组 5 12.51±1.34# 93.61±10.25# 123.87±14.63# 96.45±9.89# Sal高剂量组 5 6.49±0.73#△ 59.82±6.46#△ 91.38±10.14#△ 75.64±7.23#△ Mdivi-1组 5 25.74±2.83# 163.58±17.91# 198.53±19.74# 161.67±13.68# Sal高剂量+Mdivi-1组 5 17.85±1.83▲ 112.64±12.58▲ 154.26±17.31▲ 111.35±10.79▲ LDH: 乳酸脱氢酶; cTnI: 肌钙蛋白I; CK: 肌酸激酶同工酶; NT-proBNP: N末端B型利钠肽原。与对照组相比, * P < 0.05; 与模型组相比, #P < 0.05; 与Sal低剂量组相比, △P < 0.05; 与Sal高剂量组相比, ▲P < 0.05。 表 3 各组大鼠氧化应激指标比较(x±s)
组别 n ROS/相对荧光强度 MDA/(nmoL/g) SOD/(U/g) 对照组 5 0.21±0.04 1.53±0.52 68.52±7.41 模型组 5 0.58±0.07* 7.58±1.31* 16.91±2.08* Sal低剂量组 5 0.46±0.05# 5.16±0.93# 33.57±3.95# Sal高剂量组 5 0.31±0.04#△ 3.27±0.55#△ 59.75±6.37#△ Mdivi-1组 5 0.72±0.08# 9.06±1.47# 10.51±1.09# Sal高剂量+Mdivi-1组 5 0.55±0.08▲ 7.13±1.12▲ 22.48±2.71▲ ROS: 活性氧; MDA: 丙二醛; SOD: 超氧化物歧化酶。与对照组相比, * P < 0.05; 与模型组相比, #P < 0.05; 与Sal低剂量组相比, △P < 0.05; 与Sal高剂量组相比, ▲P < 0.05。 表 4 各组大鼠心肌组织PINK1/Parkin信号通路及自噬蛋白表达比较(x±s)
组别 n LC3Ⅱ/LC3Ⅰ Beclin1 p62 PINK1 Parkin 对照组 5 0.38±0.05 0.42±0.05 0.73±0.08 0.25±0.04 0.28±0.05 模型组 5 0.57±0.07* 0.64±0.07* 0.56±0.07* 0.48±0.05* 0.51±0.07* Sal低剂量组 5 0.92±0.10# 0.88±0.09# 0.38±0.05# 0.69±0.08# 0.99±0.10# Sal高剂量组 5 1.21±0.13#△ 1.09±0.11#△ 0.21±0.04#△ 0.97±0.10#△ 1.42±0.17#△ Mdivi-1组 5 0.35±0.04# 0.38±0.05# 0.79±0.08# 0.23±0.03# 0.33±0.06# Sal高剂量+Mdivi-1组 5 0.62±0.07▲ 0.72±0.08▲ 0.52±0.06▲ 0.52±0.06▲ 0.64±0.07▲ LC3: 微管相关蛋白轻链3; Beclin1: 肌球蛋白样Bcl-2结合蛋白; p62: 泛素结合蛋白;
PINK1: PTEN诱导激酶1; Parkin: E3泛素连接酶。与对照组相比, *P < 0.05; 与模型组相比, #P < 0.05; 与Sal低剂量组相比, △P < 0.05; 与Sal高剂量组相比, ▲P < 0.05。 -
[1] DEL BUONO M G, MORONI F, MONTONE R A, et al. Ischemic cardiomyopathy and heart failure after acute myocardial infarction[J]. Curr Cardiol Rep, 2022, 24(10): 1505-1515. doi: 10.1007/s11886-022-01766-6
[2] CHANG X, TOAN S, LI R B, et al. Therapeutic strategies in ischemic cardiomyopathy: focus on mitochondrial quality surveillance[J]. EBioMedicine, 2022, 84: 104260. doi: 10.1016/j.ebiom.2022.104260
[3] HU J G, LIU T, FU F, et al. Omentin1 ameliorates myocardial ischemia-induced heart failure via SIRT3/FOXO3a-dependent mitochondrial dynamical homeostasis and mitophagy[J]. J Transl Med, 2022, 20(1): 447. doi: 10.1186/s12967-022-03642-x
[4] WU Y Z, JIANG T, HUA J H, et al. PINK1/Parkin-mediated mitophagy in cardiovascular disease: from pathogenesis to novel therapy[J]. Int J Cardiol, 2022, 361: 61-69. doi: 10.1016/j.ijcard.2022.05.025
[5] GUAN Z J, CHEN J, WANG L H, et al. Nuanxinkang prevents the development of myocardial infarction-induced chronic heart failure by promoting PINK1/Parkin-mediated mitophagy[J]. Phytomedicine, 2023, 108: 154494. doi: 10.1016/j.phymed.2022.154494
[6] GUO Z, LIU F Y, YANG D, et al. Salidroside ameliorates pathological cardiac hypertrophy via TLR4-TAK1-dependent signaling[J]. Phytother Res, 2023, 37(5): 1839-1849. doi: 10.1002/ptr.7701
[7] TIAN X, HUANG Y, ZHANG X F, et al. Salidroside attenuates myocardial ischemia/reperfusion injury via AMPK-induced suppression of endoplasmic reticulum stress and mitochondrial fission[J]. Toxicol Appl Pharmacol, 2022, 448: 116093. doi: 10.1016/j.taap.2022.116093
[8] GU C J, LI L W, HUANG Y F, et al. Salidroside ameliorates mitochondria-dependent neuronal apoptosis after spinal cord ischemia-reperfusion injury partially through inhibiting oxidative stress and promoting mitophagy[J]. Oxid Med Cell Longev, 2020, 2020: 3549704.
[9] 范华荣, 刘丽丽, 黄永军. 针刺通过TGF-β/Smad信号通路对异丙酚麻醉缺血性心脏病大鼠心功能、血流动力学的影响[J]. 中国老年学杂志, 2023, 43(8): 1932-1936. doi: 10.3969/j.issn.1005-9202.2023.08.037 [10] YAN T X, LI X, NIAN T T, et al. Salidroside inhibits ischemia/reperfusion-induced myocardial apoptosis by targeting mir-378a-3p via the Igf1r/Pi3k/akt signaling pathway[J]. Transplant Proc, 2022, 54(7): 1970-1983. doi: 10.1016/j.transproceed.2022.05.017
[11] MAO Z G, TIAN L Y, LIU J, et al. Ligustilide ameliorates hippocampal neuronal injury after cerebral ischemia reperfusion through activating PINK1/Parkin-dependent mitophagy[J]. Phytomedicine, 2022, 101: 154111. doi: 10.1016/j.phymed.2022.154111
[12] LIGA R, COLLI A, TAGGART D P, et al. Myocardial revascularization in patients with ischemic cardiomyopathy: for whom and how[J]. J Am Heart Assoc, 2023, 12(6): e026943. doi: 10.1161/JAHA.122.026943
[13] CHANG X, LIU J F, WANG Y L, et al. Mitochondrial disorder and treatment of ischemic cardiomyopathy: potential and advantages of Chinese herbal medicine[J]. Biomedecine Pharmacother, 2023, 159: 114171. doi: 10.1016/j.biopha.2022.114171
[14] XU Q R, LIU S, GONG Q, et al. Notch1 protects against ischemic-reperfusion injury by suppressing PTEN-Pink1-mediated mitochondrial dysfunction and mitophagy[J]. Cells, 2022, 12(1): 137. doi: 10.3390/cells12010137
[15] CAI C, GUO Z Z, CHANG X, et al. Empagliflozin attenuates cardiac microvascular ischemia/reperfusion through activating the AMPKα1/ULK1/FUNDC1/mitophagy pathway[J]. Redox Biol, 2022, 52: 102288. doi: 10.1016/j.redox.2022.102288
[16] ZHANG D Q, ZHENG N, FU X L, et al. Dl-3-n-butylphthalide attenuates myocardial ischemia reperfusion injury by suppressing oxidative stress and regulating cardiac mitophagy via the PINK1/Parkin pathway in rats[J]. J Thorac Dis, 2022, 14(5): 1651-1662. doi: 10.21037/jtd-22-585
[17] JIN P, LI L H, SHI Y, et al. Salidroside inhibits apoptosis and autophagy of cardiomyocyte by regulation of circular RNA hsa_circ_0000064 in cardiac ischemia-reperfusion injury[J]. Gene, 2021, 767: 145075. doi: 10.1016/j.gene.2020.145075
[18] 彭园, 盛笑, 叶新华, 等. 高糖调节PINK1/Parkin途径刺激大鼠肾小球系膜细胞氧化应激和炎症反应的研究[J]. 实用临床医药杂志, 2021, 25(20): 6-12. doi: 10.7619/jcmp.20212562 [19] YANG T, YANG Q, LAI Q, et al. AP39 inhibits ferroptosis by inhibiting mitochondrial autophagy through the PINK1/parkin pathway to improve myocardial fibrosis with myocardial infarction[J]. Biomedecine Pharmacother, 2023, 165: 115195. doi: 10.1016/j.biopha.2023.115195
[20] TU M, TAN V P, YU J D, et al. RhoA signaling increases mitophagy and protects cardiomyocytes against ischemia by stabilizing PINK1 protein and recruiting Parkin to mitochondria[J]. Cell Death Differ, 2022, 29(12): 2472-2486. doi: 10.1038/s41418-022-01032-w
[21] ZUO W, WANG L, TIAN R, et al. Dapagliflozin alleviates myocardial ischaemia reperfusion injury by activating mitophagy via the AMPK-PINK1/parkin signalling pathway[J]. Curr Vasc Pharmacol, 2024, 22(3): 203-217. doi: 10.2174/0115701611269801231211104905





 下载:
下载:


 苏公网安备 32100302010246号
苏公网安备 32100302010246号
