Changes and clinical significance of γδT cells and their major functional subsets in peripheral blood of patients with systemic lupus erythematosus
-
摘要:目的
探讨系统性红斑狼疮(SLE)患者外周血中γδT细胞及其主要功能亚群γδT1、γδT17细胞的变化及其临床意义。
方法采用流式细胞术检测21例SLE患者(SLE组)、16例健康对照患者(HC组)外周血γδT细胞、γδT1细胞、γδT17细胞的比例及绝对数。采用Pearson相关性分析法分析外周血γδT细胞、γδT1细胞、γδT17细胞与临床指标的相关性。
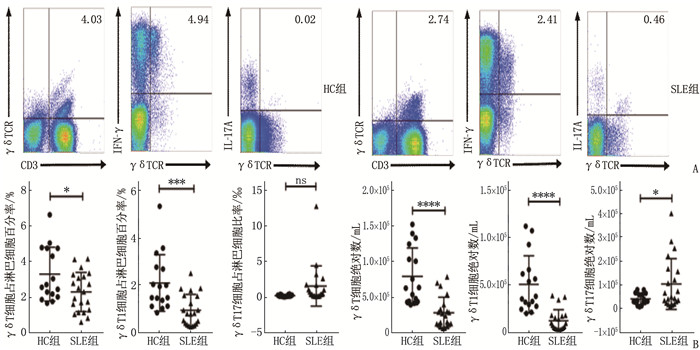
结果SLE患者外周血γδT细胞占淋巴细胞百分率为(2.30±1.10)%, 低于HC组的(3.30±1.51)%, 差异有统计学意义(P < 0.05); γδT1细胞占淋巴细胞百分率为(0.93±0.67)%, 低于HC组的(2.09±1.21)%, 差异有统计学意义(P < 0.001); γδT17细胞占淋巴细胞比率为(1.53±2.82)‰, 与HC组的(0.18±0.12)‰比较有增多的趋势,但差异无统计学意义(P>0.05)。SLE患者外周血γδT细胞绝对数为(2.88±2.18)×104/mL, 低于HC组的(7.96±3.96)×104/mL, 差异有统计学意义(P < 0.000 1); SLE患者外周血γδT1细胞绝对数为(1.20±1.17)×104/mL, 低于HC组的(5.05±3.04)×104/mL, 差异有统计学意义(P < 0.000 1); SLE患者外周血γδT17细胞绝对数为(1.03±1.08)×103/mL, 高于HC组的(0.40±0.24)×103/mL, 差异有统计学意义(P < 0.05)。SLE患者外周血中γδT17细胞比例与系统性红斑狼疮疾病活动度评分(SLEDAI)(r=0.59, P < 0.01)、红细胞沉降率(r=0.65, P < 0.01)呈正相关, γδT17细胞绝对数与SLEDAI(r=0.59, P < 0.01)呈正相关, 与补体C3水平(r=-0.53, P < 0.05)呈负相关。
结论SLE患者外周血中γδT细胞数量显著下降主要由其γδT1细胞亚群减少所致, γδT17细胞在SLE发病及活动中发挥了重要作用。
-
关键词:
- 系统性红斑狼疮 /
- γδT细胞 /
- 干扰素-γ /
- 白细胞介素-17A /
- 系统性红斑狼疮疾病活动度评分
Abstract:ObjectiveTo investigate the changes and clinical significance of γδT cells and their major functional subsets γδT1 and γδT17 cells in the peripheral blood of patients with systemic lupus erythematosus (SLE).
MethodsRatios and absolute numbers of γδT cells, γδT1 cells and γδT17 cells in peripheral blood were detected by flow cytometry in 21 SLE patients (SLE) group and 16 healthy controls (HC group). Correlations of γδT cells, γδT1 cells and γδT17 cells in the peripheral blood with clinical indicators were analyzed by Pearson correlation analysis.
ResultsIn SLE patients, the percentage of γδT cells to lymphocytes in the peripheral blood was (2.30±1.10)%, which was significantly lower than (3.30±1.51)% in the HC group (P < 0.05); the percentage of γδT1 cells to lymphocytes in peripheral blood was (0.93±0.67)%, which was significantly lower than (2.09±1.21)% in the HC group (P < 0.001); the ratio of γδT17 cells to lymphocytes in the peripheral blood was (1.53±2.82)‰, which showed an increasing trend when compared to (0.18±0.12)‰ in the HC group (P>0.05). The absolute number of γδT cells in the peripheral blood in SLE patients was (2.88±2.18)×104/mL, which was significantly lower than (7.96±3.96)×104/mL in the HC group (P < 0.000 1); the absolute number of γδT1 cells in the peripheral blood in SLE patients was (1.20±1.17)×104/mL, which was significantly lower than (5.05±3.04)×104/mL in the HC group (P < 0.000 1); the absolute number of γδT17 cells in the peripheral blood in SLE patients was (1.03±1.08)×103/mL, which was significantly higher than (0.40±0.24)×103/mL in the HC group (P < 0.05). The proportion of γδT17 cells in the peripheral blood of SLE patients was positively correlated with the Systemic Lupus Erythematosus Disease Activity Index (SLEDAI) (r=0.59, P < 0.01) and erythrocyte sedimentation rate (r=0.65, P < 0.01), while the absolute number of γδT17 cells was positively correlated with the SLEDAI score (r=0.59, P < 0.01) and negatively correlated with the complement C3 level (r=-0.53, P < 0.05).
ConclusionThe significant decrease in the number of γδT cells in the peripheral blood of SLE patients is mainly due to the reduction of its γδT1 cell subset; γδT17 cells play an important role in the pathogenesis and activity of SLE.
-
症状性颅内动脉狭窄(sICAS)是指由动脉粥样硬化引起的颅内动脉狭窄,且狭窄动脉供血区域发生过缺血性卒中或短暂性脑缺血发作[1-2]。研究[3-4]显示,1/3~1/2的缺血性卒中病例与sICAS有关。血管内支架置入术作为一种微创治疗方法,因能迅速改善大脑供血、创伤小且安全性较高,已成为治疗sICAS的主要手段[5]。然而,由于颅内血管结构复杂,支架置入过程中可能存在较高的并发症风险[6]。本研究探讨血管内支架置入术治疗sICAS患者的安全性及有效性,以期为sICAS的临床治疗提供参考依据。
1. 资料与方法
1.1 一般资料
选取北京京煤集团总医院2021年9月—2023年11月收治的100例sICAS患者作为研究对象。纳入标准: ①经影像学检查确诊sICAS者; ②临床资料完整者; ③签署知情同意书者。排除标准: ①合并颅内动脉瘤、蛛网膜下腔出血等脑血管疾病者; ②严重凝血功能异常者; ③合并精神疾病者; ④过敏体质或存在支架置入禁忌证者。采用随机数字表法将患者分为对照组和研究组,每组50例。对照组男28例,女22例; 年龄41~78岁,平均(62.31±6.52)岁; 体质量指数为(22.64±2.23)kg/m2; 颅内动脉狭窄率为(85.87±4.52)%。研究组男26例,女24例; 年龄43~77岁,平均(61.65±5.57)岁; 体质量指数为(22.51±2.30) kg/m2; 颅内动脉狭窄率为(85.23±5.47)%。2组患者基线资料比较,差异无统计学意义(P>0.05),具有可比性。
1.2 方法
对照组采用规范药物治疗方案: 口服阿司匹林肠溶片(100 mg/次, 1次/d)、氯吡格雷(75 mg/次, 1次/d)抗血小板聚集,口服阿托伐他汀钙片(10 mg/次, 1次/d)降低血脂和稳定斑块,口服氨氯地平等降压药物稳定血压(目标血压为收缩压130~150 mmHg, 舒张压70~80 mmHg, 1 mmHg=0.133 kPa)。
研究组采用血管内支架置入术治疗方案: 术前3 d口服拜阿司匹林(100 mg/次, 1次/d)、氯吡格雷(75 mg/次, 1次/d); 全身麻醉或局部麻醉下,经股动脉穿刺置管,并进行全身肝素化; 通过数字减影血管造影(DSA)确定狭窄血管病变处,并评估狭窄程度; 使用常规微导丝携带微导管至血管病变远端; 将球囊送至狭窄段,进行扩张; 扩张后,置入支架; 支架置入成功后,通过血管造影再次评估狭窄情况; 术后给予患者低分子肝素治疗3 d,并针对危险因素或手术并发症等不良事件采取相应处理措施。
1.3 观察指标
① 2组患者治疗前和治疗后14 d的颅内动脉狭窄率; ② 2组患者治疗前和治疗后14 d的神经功能,采用美国国立卫生研究院卒中量表(NIHSS)评估,总分42分,评分越高表示神经功能损伤越严重; ③ 2组患者治疗前和治疗后14 d的日常生活能力,采用日常生活活动能力量表(ADL)评估,总分100分,评分越高表示日常生活活动能力越好; ④ 2组患者治疗前与治疗后14 d的脑血流灌注指标,包括狭窄段收缩期峰值流速(PSV)和搏动指数,通过经颅彩色多普勒超声(TCCD)测量; ⑤ 2组患者不良反应发生情况,包括缺血性卒中、出血性卒中及颅内动脉再狭窄等。
1.4 统计学分析
采用SPSS 25.0统计学软件分析数据,计数资料以[n(%)]描述,比较采用χ2检验,计量资料以(x±s)描述,比较采用t检验,P < 0.05为差异有统计学意义。
2. 结果
2.1 治疗前后颅内动脉狭窄率比较
治疗前, 2组患者颅内动脉狭窄率比较,差异无统计学意义(P>0.05); 治疗后, 2组患者颅内动脉狭窄率均低于治疗前,且研究组低于对照组,差异有统计学意义(P < 0.05), 见表 1。
表 1 2组患者治疗前后颅内动脉狭窄率比较(x±s)% 组别 n 治疗前 治疗后 对照组 50 85.87±4.52 34.57±6.48* 研究组 50 85.23±5.47 12.32±3.26*# 与治疗前比较, * P < 0.05; 与对照组比较, #P < 0.05。 2.2 治疗前后神经功能比较
治疗前, 2组患者NIHSS评分比较,差异无统计学意义(P>0.05); 治疗后, 2组患者NIHSS评分均低于治疗前,且研究组低于对照组,差异有统计学意义(P < 0.05), 见表 2。
表 2 2组患者治疗前后NIHSS评分比较(x±s)分 组别 n 治疗前 治疗后 对照组 50 26.19±5.54 9.91±1.65* 研究组 50 25.42±4.86 5.47±1.28*# NIHSS: 美国国立卫生研究院卒中量表。
与治疗前比较, * P < 0.05; 与对照组比较, #P < 0.05。2.3 治疗前后日常生活能力比较
治疗前, 2组患者ADL评分比较,差异无统计学意义(P>0.05); 治疗后, 2组患者ADL评分均高于治疗前,且研究组高于对照组,差异有统计学意义(P < 0.05), 见表 3。
表 3 2组患者治疗前后ADL评分比较(x±s)分 组别 n 治疗前 治疗后 对照组 50 26.68±6.47 48.61±7.87* 研究组 50 27.43±4.51 60.97±6.75*# ADL: 日常生活活动能力量表。
与治疗前比较, * P < 0.05; 与对照组比较, #P < 0.05。2.4 治疗前后脑血流灌注指标比较
治疗前, 2组患者PSV、搏动指数比较,差异无统计学意义(P>0.05); 治疗后, 2组患者PSV、搏动指数均低于治疗前,且研究组低于对照组,差异有统计学意义(P < 0.05), 见表 4。
表 4 2组患者治疗前后脑血流灌注指标比较(x±s)组别 n PSV/(cm/s) 搏动指数 治疗前 治疗后 治疗前 治疗后 对照组 50 169.82±27.86 114.34±17.72* 1.78±0.42 1.19±0.23* 研究组 50 167.95±24.34 87.85±14.63*# 1.75±0.34 0.81±0.17*# PSV: 狭窄段收缩期峰值流速。与治疗前比较, * P < 0.05; 与对照组比较, #P < 0.05。 2.5 不良反应发生情况比较
研究组患者的不良反应发生率低于对照组,差异有统计学意义(P < 0.05), 见表 5。
表 5 2组患者不良反应发生情况比较[n(%)]组别 n 缺血性卒中 出血性卒中 颅内动脉再狭窄 合计 对照组 50 5(10.00) 1(2.00) 2(4.00) 8(16.00) 研究组 50 2(4.00) 0 1(2.00) 3(6.00)* 与对照组比较, * P < 0.05。 3. 讨论
卒中是导致人类残疾和死亡的主要原因之一,急性缺血性卒中约占全部卒中的80%[7-9], 治疗的关键在于尽早开通阻塞血管,挽救缺血半暗带[10-12]。sICAS是指由动脉粥样硬化引起的颅内动脉狭窄,且在狭窄动脉供血区域发生过缺血性卒中或短暂性脑缺血发作[13-15]。抗血小板治疗和降脂稳定斑块是sICAS的重要治疗手段,但部分患者接受规范药物治疗后仍会出现症状复发或病情进展。此外,口服抗血小板药物起效时间及持续时间较长,短时间内无法重复给药,且可能存在口服药物抵抗等现象,进一步加重了患者及其家属的身心负担及经济压力[16-17]。因此,探寻一种安全有效的治疗方法对于改善sICAS患者的预后具有重要意义。
随着医学技术的不断发展,血管内治疗(如支架置入、狭窄血管段球囊扩张等)已成为开通“罪犯”血管、提高远端血管支配区脑组织血液供应的重要手段,显著提升了sICAS患者的临床疗效[18-20]。目前,颅内动脉支架置入已被广泛应用于颈内动脉狭窄的治疗,并成为神经科研究的热点之一[21-22]。颅内动脉支架置入治疗能在短期内迅速改善大脑供血,为急性卒中的治疗提供了新方向。然而,支架内再狭窄仍是颅内支架置入术后的主要问题之一[23]。李振强等[24]回顾性分析15例重度sICAS患者的颅内支架置入情况,结果显示所有支架一次性释放成功,手术成功率为100%, 患者未出现缺血性卒中、短暂性脑缺血发作和颅内出血等情况,随访影像学资料显示仅1例患者发生支架内再狭窄,表明颅内支架置入治疗的成功率较高,并发症较少,且随访效果良好。
本研究结果显示,研究组患者治疗后颅内动脉狭窄率显著低于对照组,表明支架置入相较于药物治疗可显著降低狭窄率; 研究组患者治疗后NIHSS评分显著低于对照组,表明支架置入相较于药物治疗可显著改善患者神经功能; 研究组患者治疗后ADL评分显著高于对照组,表明支架置入相较于药物治疗可显著改善患者的日常生活活动能力; 研究组患者治疗后PSV和搏动指数显著低于对照组,表明支架置入相较于药物治疗可显著改善患者的脑血流灌注情况; 研究组患者的不良反应发生率显著低于对照组,表明支架置入相较于药物治疗可显著减少不良反应。
综上所述,血管内支架置入术治疗sICAS患者具有良好的有效性,能够显著降低颅内动脉狭窄率,改善患者的神经功能和日常生活活动能力,且安全性较高。
-
表 1 SLE患者外周血γδT细胞比例及数量与临床指标的相关性分析
临床指标 γδT细胞比例 γδT细胞绝对数 r P r P SLEDAI/分 0.40 0.09 -0.12 0.63 红细胞沉降率/(mm/h) 0.17 0.52 -0.37 0.15 C反应蛋白/(mg/L) -0.12 0.62 -0.15 0.56 24 h尿蛋白量/(mg/mL) -0.30 0.28 -0.27 0.33 血肌酐/(μmol/L) -0.01 0.96 -0.10 0.69 尿素氮/(mmol/L) 0.12 0.64 -0.06 0.80 eGFR/[mL/(min·1.73 m2)] -0.09 0.72 0.07 0.78 补体C3/(g/L) -0.28 0.30 0.25 0.35 补体C4/(g/L) -0.22 0.41 0.02 0.93 SLEDAI: 系统性红斑狼疮疾病活动度评分; eGFR: 估算肾小球滤过率。 表 2 SLE患者外周血γδT1细胞比例及数量与临床指标的相关性分析
临床指标 γδT1细胞比例 γδT1细胞绝对数 r P r P SLEDAI/分 0.35 0.15 -0.01 0.95 红细胞沉降率/(mm/h) -0.08 0.75 -0.47 0.06 C反应蛋白/(mg/L) -0.27 0.27 -0.25 0.31 24 h尿蛋白量/(mg/mL) -0.28 0.30 -0.27 0.32 血肌酐/(μmol/L) 0.17 0.49 0.02 0.94 尿素氮/(mmol/L) 0.37 0.13 0.07 0.79 eGFR/[mL/(min·1.73 m2)] -0.24 0.34 -0.07 0.79 补体C3/(g/L) -0.58 0.02 -0.07 0.81 补体C4/(g/L) -0.31 0.24 -0.15 0.58 表 3 SLE患者外周血γδT17细胞比例及数量与临床指标的相关性分析
临床指标 γδT17细胞比例 γδT17细胞绝对数 r P r P SLEDAI/分 0.59 < 0.01 0.59 < 0.01 红细胞沉降率/(mm/h) 0.65 < 0.01 0.43 0.08 C反应蛋白/(mg/L) -0.03 0.90 -0.23 0.36 24 h尿蛋白量/(mg/mL) -0.03 0.91 -0.09 0.76 血肌酐/(μmol/L) -0.07 0.79 -0.13 0.61 尿素氮/(mmol/L) -0.07 0.79 0.03 0.89 eGFR/[mL/(min·1.73 m2)] -0.01 0.97 0.17 0.51 补体C3/(g/L) -0.38 0.14 -0.53 0.03 补体C4/(g/L) -0.14 0.61 -0.37 0.20 -
[1] OCAMPO-PIRAQUIVE V, NIETO-ARISTIZABAL I, CANAS C A, et al. Mortality in systemic lupus erythematosus: causes, predictors and interventions[J]. Expert Rev Clin Immunol, 2018, 14(12): 1043-1053. doi: 10.1080/1744666X.2018.1538789
[2] AMEER M A, CHAUDHRY H, MUSHTAQ J, et al. An overview of systemic lupus erythematosus (SLE) pathogenesis, classification, and management[J]. Cureus, 2022, 14(10): e30330.
[3] PAUL S, SINGH A K, SHILPI, et al. Phenotypic and functional plasticity of gamma-delta (γδ) T cells in inflammation and tolerance[J]. Int Rev Immunol, 2014, 33(6): 537-558. doi: 10.3109/08830185.2013.863306
[4] SHIROMIZU C M, JANCIC C C. γδ T lymphocytes: an effector cell in autoimmunity and infection[J]. Front Immunol, 2018, 9: 2389.
[5] WU D, WU P, QIU F M, et al. Human γδT-cell subsets and their involvement in tumor immunity[J]. Cell Mol Immunol, 2017, 14(3): 245-253.
[6] DENG J C, YIN H N. Gamma delta (γδ) T cells in cancer immunotherapy; where it comes from, where it will go?[J]. Eur J Pharmacol, 2022, 919: 174803.
[7] LU H, LI D J, JIN L P. γδT cells and related diseases[J]. Am J Reprod Immunol, 2016, 75(6): 609-618. doi: 10.1111/aji.12495
[8] SONG Y, LIU Y H, TEO H Y, et al. Targeting cytokine signals to enhance γδT cell-based cancer immunotherapy[J]. Front Immunol, 2022, 13: 914839.
[9] PRINZ I, SILVA-SANTOS B, PENNINGTON D J. Functional development of γδ T cells[J]. Eur J Immunol, 2013, 43(8): 1988-1994.
[10] FIALA G J, GOMES A Q, SILVA-SANTOS B. From thymus to periphery: molecular basis of effector γδ-T cell differentiation[J]. Immunol Rev, 2020, 298(1): 47-60.
[11] RAJAGOPALAN S, ZORDAN T, TSOKOS G C, et al. Pathogenic anti-DNA autoantibody-inducing T helper cell lines from patients with active lupus nephritis: isolation of CD4-8- T helper cell lines that express the gamma delta T-cell antigen receptor[J]. Proc Natl Acad Sci USA, 1990, 87(18): 7020-7024.
[12] LUNARDI C, MARGUERIE C, BOWNESS P, et al. Reduction in T gamma delta cell numbers and alteration in subset distribution in systemic lupus erythematosus[J]. Clin Exp Immunol, 1991, 86(2): 203-206.
[13] ROBAK E, BŁONSKI J Z, BARTKOWIAK J, et al. Circulating TCR gammadelta cells in the patients with systemic lupus erythematosus[J]. Mediators Inflamm, 1999, 8(6): 305-312.
[14] LU Z M, SU D L, WANG D D, et al. Elevated apoptosis and impaired proliferation contribute to downregulated peripheral γδ T cells in patients with systemic lupus erythematosus[J]. Clin Dev Immunol, 2013, 2013: 405395.
[15] YIN S S, MAO Y J, LI X M, et al. Hyperactivation and in situ recruitment of inflammatory Vδ2 T cells contributes to disease pathogenesis in systemic lupus erythematosus[J]. Sci Rep, 2015, 5: 14432.
[16] PAPOTTO P H, RIBOT J C, SILVA-SANTOS B. IL-17+ γδ T cells as kick-starters of inflammation[J]. Nat Immunol, 2017, 18(6): 604-611.
[17] ROARK C L, FRENCH J D, TAYLOR M A, et al. Exacerbation of collagen-induced arthritis by oligoclonal, IL-17-producing gamma delta T cells[J]. J Immunol, 2007, 179(8): 5576-5583.
[18] QI C, WANG Y Z, LI P, et al. Gamma delta T cells and their pathogenic role in psoriasis[J]. Front Immunol, 2021, 12: 627139.
[19] GAN P Y, FUJITA T, OOI J D, et al. Pathogenic role for γδ T cells in autoimmune anti-myeloperoxidase glomerulonephritis[J]. J Immunol, 2017, 199(9): 3042-3050.
[20] RAFAEL-VIDAL C, PÉREZ N, ALTABÁS I, et al. Blocking IL-17: a promising strategy in the treatment of systemic rheumatic diseases[J]. Int J Mol Sci, 2020, 21(19): 7100.
[21] PISITKUN P, HA H L, WANG H S, et al. Interleukin-17 cytokines are critical in development of fatal lupus glomerulonephritis[J]. Immunity, 2012, 37(6): 1104-1115.
[22] ABDEL GALIL S M, EZZELDIN N, EL-BOSHY M E. The role of serum IL-17 and IL-6 as biomarkers of disease activity and predictors of remission in patients with lupus nephritis[J]. Cytokine, 2015, 76(2): 280-287.
[23] DOREAU A, BELOT A, BASTID J, et al. Interleukin 17 acts in synergy with B cell-activating factor to influence B cell biology and the pathophysiology of systemic lupus erythematosus[J]. Nat Immunol, 2009, 10(7): 778-785.
[24] MOU W J, HAN W, MA X L, et al. γδTFH cells promote B cell maturation and antibody production in neuroblastoma[J]. BMC Immunol, 2017, 18(1): 36.
[25] SUN D M, CHAN N, SHAO H, et al. γδ T cells activated in different inflammatory environments are functionally distinct[J]. J Immunol, 2022, 208(5): 1224-1231.
[26] MUSCHAWECKH A, PETERMANN F, KORN T. IL-1β and IL-23 promote extrathymic commitment of CD27+CD122- γδ T cells to γδT17 cells[J]. J Immunol, 2017, 199(8): 2668-2679.




 下载:
下载:
 苏公网安备 32100302010246号
苏公网安备 32100302010246号
