Value of Wilms tumor 1 gene combined with multiparameter flow cytometry for minimal residual disease in evaluating prognosis of children with acute myeloid leukemia
-
摘要:
目的分析肾母细胞瘤1(WT1)基因联合多参数流式细胞术检测微小残留病灶(FCM-MRD)对急性髓系白血病(AML)患儿预后的预测价值。
方法回顾性分析76例AML患儿的临床资料及一般信息。患儿治疗前均采用实时荧光定量聚合酶链式反应(qRT-PCR)检测WT1基因表达,并经FCM检测MRD。所有患儿随访1年,根据预后情况的不同分为预后良好组(n=40)和预后不良组(n=36)。观察2组患儿治疗前及治疗后3、9、12个月的WT1基因及MRD变化情况; 比较不同治疗方案患儿治疗前后WT1基因及MRD变化情况; 分析AML患儿临床病理特征与WT1基因表达及FCM-MRD阳性率的关系。采用Spearman相关系数分析WT1基因表达、FCM-MRD阳性率与AML患儿预后的关系; 绘制Kaplan-Meier生存曲线,分析WT1基因表达、FCM-MRD阳性率对AML患儿复发的影响及相关性; 绘制受试者工作特征(ROC)曲线分析WT1基因、FCM-MRD单一及联合检测对AML患儿预后的预测效能; 分析WT1基因、MRD与AML患儿FLT3 ITD/TKD突变的关系。
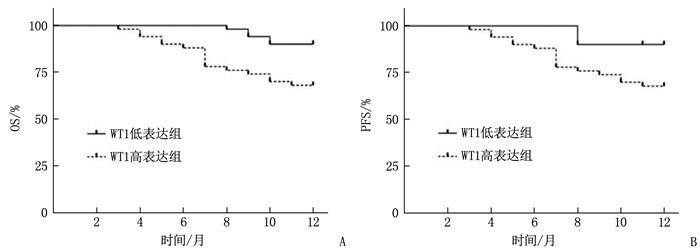
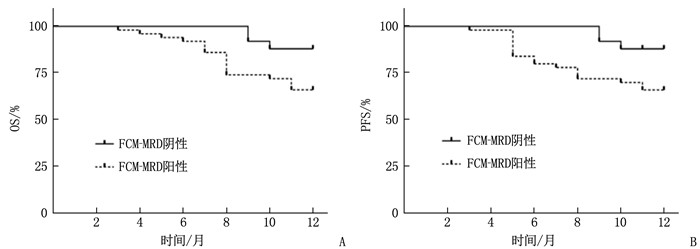
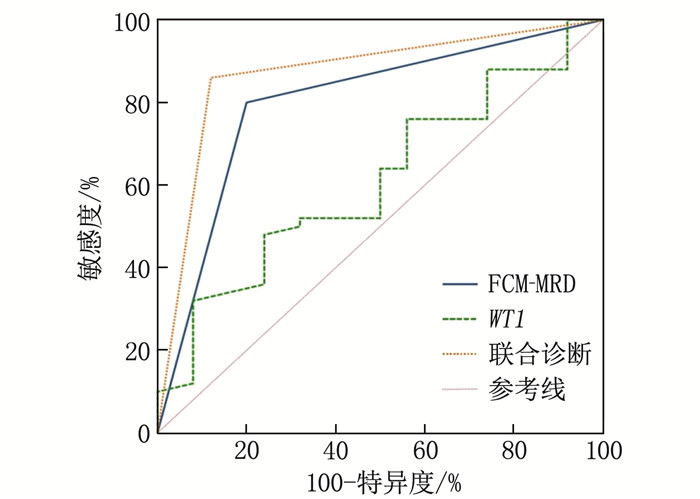
结果预后良好组患儿治疗后9、12个月的WT1表达量及FCM-MRD阳性率低于预后不良组,差异有统计学意义(P<0.05); 接受DAH化疗方案患儿的WT1基因表达、FCM-MRD阳性率低于接受DAE化疗方案患儿,预后良好率高于接受DAE化疗方案患儿,但差异无统计学意义(P>0.05); WT1基因表达及FCM-MRD阳性率与AML患儿白细胞计数、FAB分型、骨髓原始细胞及细胞遗传学分组具有相关性(P<0.05)。Spearman相关系数分析显示, WT1基因表达、FCM-MRD阳性率与AML患儿预后呈显著负相关(P<0.05); Kaplan-Meier生存曲线验证显示, WT1高表达患儿总生存期(OS)、无进展生存期(PFS)均低于WT1低表达患儿,差异有统计学意义(χ2=4.215、9.530, P=0.040、0.002), FCM-MRD阳性患儿OS、PFS均低于FCM-MRD阴性患儿, 差异也有统计学意义(χ2=5.144、6.381, P=0.023、0.012); Spearman相关系数分析显示, WT1基因表达与AML患儿OS、PFS呈显著负相关(P<0.05); ROC曲线显示, WT1联合FCM-MRD的曲线下面积显著高于单一指标检测结果,敏感度为88.89%, 特异度为87.50%; Spearman相关性分析显示,WT1基因表达、FCM-MRD阳性率与FLT3 ITD/TKD突变无相关性(P>0.05)。
结论WT1表达水平及FCM-MRD阳性率在不同预后AML患儿中具有特异性变化,与AML患儿预后具有强关联性,二者联合检测能够有效预测AML患儿的预后。
Abstract:ObjectiveTo analyze the value of Wilms tumor 1 (WT1) gene combined with multiparameter flow cytometry for minimal residual disease (FCM-MRD) in evaluating prognosis of children with acute myeloid leukemia (AML).
MethodsThe clinical data and general information of 76 children with AML were retrospectively analyzed. Before treatment, WT1 gene expression was detected by real-time fluorescence quantitative polymerase chain reaction (qRT-PCR) in all the children, and MRD was detected by FCM. All the children were followed up for a year, and they were divided into good prognosis group (n=40) and poor prognosis group (n=36) according to prognosis condition. The changes of WT1 gene and MRD before treatment and 3, 9 and 12 months after treatment were observed in both groups; the changes of WT1 gene and MRD before and after treatment were compared in the children with different therapeutic plans; the relationships of clinicopathological features with WT1 gene expression and positive rate of FMM-MRD were analyzed in AML children. Spearman correlation coefficient was used to analyze the relationships of WT1 gene expression and positive rate of FCM-MRD with the prognosis of AML children; the Kaplan-Meier survival curve was drawn to analyze the effects of WT1 gene expression and positive rate of FMM-MRD on the recurrence of AMLchildren and their correlations; the receiver operating characteristic (ROC) curve was drawn to analyze the efficiencies of single detection with WT1 gene and FMM-MRD and combined detection in predicting prognosis of AML children; the relationships of WT1 gen and MRD with FLT3 ITD/TKD mutation were analyzed in AML children.
ResultsThe WT1 expression levels and positive rates of FCM-MRD at 9 and 12 months after treatment in the good prognosis group were significantly lower than those in the poor prognosis group (P<0.05); the WT1 gene expression level and positive rate of FCM-MRD in children with DAH chemotherapy regimen were lower than those in children with DAE chemotherapy regimen, while the rate of good prognosis was higher than thatin children with DAE chemotherapy regimen, but there were no significant differences between children with different chemotherapy regimens (P>0.05); the WT1 gene expression and the positive rate of FCM-MRD were significantly correlated with white blood cell count, FAB typing, bone marrow primitive cells, and cytogenetic grouping in AML children (P<0.05). Spearman correlation coefficient analysis showed the WT1 gene expression and positive rate of FCM-MRD were significantly negatively correlated with prognosis of AML children (P<0.05); the Kaplan-Meier survival curve validation showed that overall survival (OS) and progression free survival (PFS) in children with high expression of WT1 were significantly lower than those in children with low expression of WT1 (χ2=4.215, 9.530; P=0.040, 0.002), and OS and PFS in children with positive FCM-MRD were also significantly lower than those in children with negative FCM-MRD (χ2=5.144, 6.381; P=0.023, 0.012); the Spearman correlation coefficient analysis showed that the WT1 gene expression was significantly negatively correlated with OS and PFS in AML children (P<0.05); the ROC curve showed that the area under the curve of WT1 combined with FCM-MRD was significantly higher than that of single indicator detection, with a sensitivity of 88.89% and a specificity of 87.50%; the Spearman correlation analysis showed that there were no significant correlations of WT1 gene expression and positive rate of FCM-MRD with FLT3 ITD/TKD mutation (P>0.05).
ConclusionThe expression level of WT1 and the positive rate of FCM-MRD show specific changes in AML children with different prognosis, and are strongly correlated with the prognosis of AML children. Combined detection of the two indicators can effectively predict the prognosis of AML children.
-
脓毒症是由严重感染引起的全身炎症反应综合征,其特征是感染灶产生的毒力因子进入血液循环,引发的全身炎症反应[1]。这些炎症反应进一步导致器官功能障碍,其中急性肺损伤(ALI)是最严重的并发症之一,其特点是肺组织受损导致肺功能急剧下降,诊治不及时可能进一步发展为急性呼吸窘迫综合征[2]。研究[2]表明, ALI的发病与炎性因子释放和损伤程度密切相关。炎性因子,特别是肿瘤坏死因子-α(TNF-α)、白细胞介素-6(IL-6)和白细胞介素-1(IL-1)等,在脓毒症患者中起到重要的调节作用,可以刺激炎症细胞增殖和迁移,导致肺泡壁的炎症浸润和肺水肿形成[3]。目前,ALI的早期诊断和预后评估仍然是一个临床难题。因此,寻找新的生物标志物和分子指标对早期诊断、预测疾病进展和评估预后具有重要意义。
微小RNA(miRNA)可通过抑制靶基因的转录、调控蛋白翻译等方式发挥调控作用。研究[4]发现, miRNA在炎症反应中起到重要作用。miR-499a-5p是miR-499家族中的一员,已被发现参与多种生物过程,包括心脏疾病和肿瘤的进展[5]。但关于miR-499a-5p在脓毒症所致ALI中的作用及其与病情、预后的相关研究较少。生物信息学预测发现,成纤维细胞生长因子9(FGF9)存在与miR-499a-5p相互作用的结合位点。FGF9是一种与炎症相关的生长因子,已被证实在多种炎性疾病中起到重要调节作用[6]。本研究探讨血清miR-499a-5p和FGF9的表达与ALI患者(脓毒症所致)炎性因子、病情和预后的关系,旨在为该病的检测、治疗提供新思路和理论依据。
1. 资料与方法
1.1 一般资料
选取2020年1月—2023年1月住院接受诊治的151例脓毒症患者为研究对象,年龄49~77岁。收集患者年龄、性别、体质量指数(BMI)、体温、氧合指数、急性生理学与慢性健康状况评分系统Ⅱ(APACHEⅡ)评分以及IL-1、IL-6、TNF-α、C反应蛋白(CRP)水平。根据ALI的发生情况分为脓毒症并发ALI组(68例)和一般脓毒症组(83例)。根据氧合指数,将脓毒症并发ALI患者分为轻症组(23例)、中症组(26例)和重症组(19例)。以脓毒症并发ALI患者诊治28 d内的生存情况,分为预后良好组(43例)和预后不良组(25例)。另外,选择同期体检健康者151例为健康组。
纳入标准: ①患者均符合《中国脓毒症/脓毒性休克急诊治疗指南(2018)》[7]中关于脓毒症的诊治标准者; ② ALI患者根据2017年Kigali[8]修订的柏林定义判定; ③患者年龄>18岁且资料齐全。排除标准: ①由肺部手术、腐蚀性气体和溺水等情况造成的ALI者; ②病毒性疾病者; ③经临床确诊的肺癌、慢性阻塞性肺疾病、支气管哮喘、肺纤维化等肺部疾病者; ④自身免疫疾病、血液系统疾病者。患者均知情并签署同意书。研究获得本院伦理委员会批准(审批编号LL20200016)。
1.2 方法
1.2.1 样品采集
采集脓毒症患者入院时及健康者体检时空腹静脉血样5 mL, 于无菌试管静置30 min后, 1 000 r/min离心20 min, 存于-80 ℃冰箱待测。
1.2.2 实时荧光定量聚合酶链反应(qRT-PCR)检测miR-499a-5p水平
待测样以Trizol试剂(上海源叶生物科技有限公司)提取总RNA,逆转录合成cDNA(逆转录试剂盒由北京天根生物有限公司提供),内参为 U6 , 引物由Primer-BLAST网站设计,由南京金斯瑞生物科技公司合成,引物序列见表 1。以cDNA为模板,通过LightCycler 480Ⅱ型qRT-PCR仪(美国ABI公司)检测血清miR-499a-5p水平,各样品重复3次,以2-△△Ct法计算目的基因miR-499a-5p的相对表达量。
表 1 qRT-PCR引物序列基因 上游引物5′-3′ 下游引物5′-3′ miR-499a-5p AGTTGGCTCACGGTTCTTTCAA ATCGCCATGGCCCGCATGTCGG U6 GCTTCGGCAGCACATATACTAAAAT CGCTTCACGAATTTGCGTGTCAT 1.2.3 酶联免疫吸附试验(ELISA)检测FGF9及炎症因子水平
人FGF9、IL-1、IL-6、TNF-α、CRP的ELISA试剂盒均购自合肥莱尔生物科技有限公司,酶标仪(型号: Varioskan LUX)购买于赛默飞世尔科技(中国)。严格按照说明书操作配置标准液,在酶标仪450 nm处测定各样品的吸光度值,并绘制回归线带入吸光度值计算血清FGF9及各炎症因子水平。
1.3 统计学分析
采用SPSS 25.0软件进行数据处理,计量资料均符合正态分布,以(x±s)表示,组间比较采用独立样本t检验,多组间比较采用单因素方差分析,进一步两两比较采用SNK-q检验,计数资料以[n(%)]表示,采用χ2检验。采用Pearson法分别分析血清miR-499a-5p、FGF9与炎性因子的相关性, miR-499a-5p与FGF9间的相关性。采用受试者工作特征(ROC)曲线分析miR-499a-5p、FGF9对脓毒症并发ALI患者预后的预测效能。P < 0.05为差异有统计学意义。
2. 结果
2.1 脓毒症并发ALI组、一般脓毒症组与健康组临床资料比较
脓毒症并发ALI组、一般脓毒症组与健康组年龄、性别、BMI和体温比较,差异无统计学意义(P>0.05), APACHEⅡ评分、miR-499a-5p、FGF9、IL-1、IL-6、TNF-α、CRP比较,差异有统计学意义(P < 0.05), 见表 2。
表 2 3组间临床资料比较(x±s)指标 脓毒症并发ALI组(n=68) 一般脓毒症组(n=83) 健康组(n=151) 年龄/岁 50.34±7.18 50.17±8.12 49.22±5.25 性别 男 37 44 73 女 31 39 78 BMI/(kg/m2) 22.37±2.36 22.48±2.04 22.42±1.75 体温/℃ 37.97±2.28 37.52±4.16 36.84±4.35 APACHEⅡ评分/分 16.78±2.36# 13.65±1.87 — 氧合指数/mmHg 212.77±21.68# 334.28±29.82 — miR-499a-5p 0.87±0.07*# 1.15±0.14* 1.29±0.13 FGF9/(pg/mL) 137.38±14.22*# 147.58±18.19* 160.84±19.91 IL-1/(pg/mL) 23.77±3.19*# 17.84±2.57* 10.95±1.52 IL-6/(pg/mL) 16.14±2.13*# 10.87±1.65* 7.87±0.91 TNF-α/(ng/L) 17.31±2.09*# 13.18±1.44* 8.79±1.02 CRP/(mg/L) 26.49±3.78*# 20.74±3.52* 10.88±2.06 BMI: 体质量指数; APACHEⅡ: 急性生理学与慢性健康状况评分系统Ⅱ; FGF9: 成纤维细胞生长因子9; IL-1: 白细胞介素-1; IL-6: 白细胞介素-6; TNF-α: 肿瘤坏死因子-α; CRP: C反应蛋白。
1 mmHg=0.133 322 kPa。
与健康组比较, * P < 0.05; 与一般脓毒症组比较, #P < 0.05。2.2 血清miR-499a-5p、FGF9及炎性因子在不同病情程度患者中的表达水平
轻症组、中症组、重症组患者miR-499a-5p和FGF9水平依次降低,而炎症因子IL-1、IL-6、TNF-α、CRP水平依次升高,差异有统计学意义(P < 0.05), 见表 3。
表 3 不同病情程度患者的miR-499a-5p、FGF9及炎性因子水平比较(x±s)指标 轻症组(n=23) 中症组(n=26) 重症组(n=19) miR-499a-5p 1.06±0.12 0.83±0.06* 0.71±0.06*# FGF9/(pg/mL) 169.67±15.58 134.09±13.37* 102.81±10.19*# IL-1/(pg/mL) 18.84±2.12 24.53±2.54* 28.69±3.07*# IL-6/(pg/mL) 12.12±1.83 16.77±2.05* 20.15±2.47*# TNF-α/(ng/L) 13.47±1.16 17.14±1.37* 22.19±2.39*# CRP/(mg/L) 16.18±2.04 27.62±2.83* 37.41±3.42*# FGF9: 成纤维细胞生长因子9; IL-1: 白细胞介素-1; IL-6: 白细胞介素-6; TNF-α: 肿瘤坏死因子-α; CRP: C反应蛋白。
与轻症组比较, * P < 0.05; 与中症组比较, #P < 0.05。2.3 血清miR-499a-5p、FGF9及炎性因子在不同预后患者中的表达水平
与预后良好组相比,预后不良组的miR-499a-5p、FGF9降低,炎症因子IL-1、IL-6、TNF-α、CRP水平升高,差异有统计学意义(P < 0.05), 见表 4。
表 4 不同预后患者的miR-499a-5p、FGF9及炎性因子水平比较(x±s)指标 预后良好组(n=43) 预后不良组(n=25) miR-499a-5p 1.01±0.17 0.62±0.08* FGF9/(pg/mL) 151.67±19.17 112.81±14.34* IL-1/(pg/mL) 20.58±2.35 29.29±3.62* IL-6/(pg/mL) 12.65±1.91 22.15±2.54* TNF-α/(ng/L) 12.06±1.34 26.35±2.91* CRP/(mg/L) 19.45±1.71 38.59±4.48* FGF9: 成纤维细胞生长因子9; IL-1: 白细胞介素-1; IL-6: 白细胞介素-6; TNF-α: 肿瘤坏死因子-α; CRP: C反应蛋白。
与预后良好组比较, * P < 0.05。2.4 脓毒症并发ALI组的miR-499a-5p、FGF9与炎症因子的相关性
采用Pearson法分析ALI组miR-499a-5p、FGF9与炎症因子的相关性,结果显示,miR-499a-5p、FGF9与炎症因子IL-1、IL-6、TNF-α和CRP水平呈负相关(P < 0.05), 见表 5。
表 5 脓毒症并发ALI组miR-499a-5p、FGF9与炎症因子的相关性指标 miR-499a-5p FGF9/(pg/mL) r P r P IL-1/(pg/mL) -0.463 0.013 -0.537 0.006 IL-6/(pg/mL) -0.619 <0.001 -0.552 <0.001 TNF-α/(ng/L) -0.438 0.021 -0.484 0.017 CRP/(mg/L) -0.514 0.005 -0.510 0.008 FGF9: 成纤维细胞生长因子9; IL-1: 白细胞介素-1; IL-6: 白细胞介素-6; TNF-α: 肿瘤坏死因子-α; CRP: C反应蛋白。 2.5 miR-499a-5p靶向FGF9的生物信息学分析
根据TargetScanHuman网站预测结果, miR-499a-5p与FGF9可能存在靶向关系,见图 1。
2.6 脓毒症并发ALI组miR-499a-5p、FGF9的相关性
经Pearson相关分析,脓毒症并发ALI组血清miR-499a-5p与FGF9表达呈正相关(r=0.447, P < 0.05), 见图 2。
2.7 血清miR-499a-5p、FGF9水平对脓毒症并发ALI患者预后的预测价值
miR-499a-5p、FGF9联合预测脓毒症并发ALI患者预后的曲线下面积(AUC)大于单独预测(Z二者联合-miR-499a-5p=2.864、Z二者联合-FGF9=2.126, P=0.004、0.034), 见表 6、图 3。
表 6 血清miR-499a-5p、FGF9对脓毒症并发ALI患者预后的预测价值变量 AUC 截断值 95%CI 灵敏度 特异度 Youden指数 miR-499a-5p 0.787 0.87 0.671~0.877 0.760 0.721 0.481 FGF9 0.809 130.11 pg/mL 0.696~0.894 0.720 0.860 0.581 二者联合 0.949 — 0.867~0.988 0.960 0.814 0.774 FGF9: 成纤维细胞生长因子9; AUC: 曲线下面积。 3. 讨论
脓毒症导致的ALI是脓毒症并发症中最常见的一种,其是导致患者病死率偏高的重要原因[9-12]。研究[13-15]显示,炎性因子在脓毒症相关ALI中发挥重要作用,当机体炎症调控因子失衡,患者往往会病情恶化,器官功能持续性下降,最终危及生命。近年来,脓毒症和ALI的治疗方法不断改进,但其预后仍然堪忧。因此,寻找敏感度且特异性高的生物标志物对早期诊治ALI至关重要。
miRNA在多种生理和病理过程中发挥调控作用,参与细胞增殖、分化、凋亡[16]。miRNA已被证实在多种疾病中具有调控作用,如心肌梗死和肾脏损伤[17]。miR-499a-5p已被证实在脓毒症及炎症反应中起到调控作用[18]。大鼠实验[19]证明,miR-499a-5p可靶向负调控质金属蛋白酶-16, 减轻炎症,进而减轻肺损伤。在CHEN Y L等[20]研究中,肺炎患者外周血中miR-499a-5p表达下调,炎性细胞因子表达异常增高,提示两者可能具有相关性。目前, miR-499a-5p是否与脓毒症所致ALI有关尚不明确。本研究比较脓毒症并发ALI组患者与一般脓毒症组患者的血清miR-499a-5p水平发现, miR-499a-5p水平下调,提示其可能参与了脓毒症导致的ALI发病过程。同时,本研究观察到炎症因子(IL-1、IL-6、TNF-α和CRP)水平在轻症组、中症组和重症组中呈递增趋势,而miR-499a-5p表达水平随疾病的严重程度增高而呈逐渐递减趋势,这表明miR-499a-5p可能在ALI的发展与抗炎机制有关。进一步相关性分析证实, miR-499a-5p与炎症因子表达均呈负相关,表明其可能通过抑制炎症信号通路来减轻病程。此外,预后不良组中的miR-499a-5p的表达水平显著降低,而炎症因子水平显著升高,这提示miR-499a-5p下调可能与疾病恶化、预后不良有关。ROC分析结果显示, miR-499a-5p预测脓毒症导致的ALI预后的效能较高,提示血清miR-499a-5p可作为预测脓毒症并发ALI患者预后的辅助检测指标。
本研究通过生物信息学预测到FGF9与miR-499a-5p存在相互作用的结合位点。既往研究[21]表明, FGF9是一种具有广泛生物学功能的多肽生长因子,可参与多种生物过程,主要作为细胞发育和组织修复的信号分子,其表达或突变与多种疾病相关。研究[22]发现, FGF9通过促进黏着斑激酶(FAK)、蛋白激酶B(AKT)和细胞外信号调节激酶(ERK)信号传导可显著诱导肺癌细胞中的细胞增殖。研究[23]发现, FGF9表达下调促进了细胞脂质积累, FGF9通过自分泌方式调节肝脂代谢来缓解脂肪肝表型。此外, FGF9还和机体的炎症相关。研究[6]结果显示, FGF9可通过调节磷酸肌醇3激酶(PI3K)/AKT信号通路的激活来减轻机体炎症。研究[24]表明, FGF9可调节长非编码RNA NEAT1缓解溃疡性结肠炎的炎症。但FGF9在脓毒症相关ALI中的研究较少。本研究中,与一般脓毒症组相比,脓毒症并发ALI组的FGF9水平下调,提示FGF9与脓毒症导致ALI的发生可能存在相关性。同时,发现FGF9的表达水平随着病情严重程度递减,与炎症因子表达趋势相反,这表明FGF9可能与ALI病情严重程度及炎症反应机制有关。进一步通过相关性分析证实, FGF9与炎症因子之间均呈负相关。此外, FGF9在预后不良组中显著下降,提示FGF9的下调可能与患者的预后情况相关。ROC曲线预测脓毒症并发ALI患者的预后情况表明, FGF9具有成为预测脓毒症并发ALI患者预后的辅助指标的潜力。
本研究还对脓毒症并发ALI患者的血清miR-499a-5p与FGF9的相关性进行了分析,发现两者间具有正相关性,这也提示两者间可能存在靶向关系,在脓毒症与ALI的发病机制中起到协同作用。本研究结果显示,与miR-499a-5p、FGF9单独预测相比,两者联合预测具有更高的AUC和灵敏度。这表明两者联合应用可以提高预测模型的诊断效能,可为临床评估脓毒症并发ALI患者的病程和预后提供新的生物学标志物,以及为疾病的早期诊断和治疗提供依据。但本研究存在一些限制:首先,样本容量相对较小,可能影响结果的稳定性;其次,本研究仅分析了患者入院时miR-499a-5p、FGF9的表达水平,未能进一步探究二者动态水平变化,后续将扩大样本量,深入分析二者作用机制。
综上所述, miR-499a-5p、FGF9水平与脓毒症所致ALI患者的炎性因子水平和预后相关。miR-499a-5p和FGF9或可作为潜在生物标志物用于脓毒症并发ALI的预后评估。
-
表 1 2组AML患儿不同时点WT1基因表达及FCM-MRD阳性率变化(x±s)[n(%)]
组别 时点 WT1基因 FCM-MRD阳性 预后良好组(n=40) 治疗前 0.80±0.34 — 治疗后3个月 0.85±0.31 23(57.50) 治疗后9个月 0.59±0.26 21(52.50) 治疗后12个月 0.73±0.37 19(47.50) 预后不良组(n=36) 治疗前 0.88±0.33 — 治疗后3个月 0.81±0.32 28(77.78) 治疗后9个月 0.73±0.37* 32(88.89)* 治疗后12个月 0.82±0.41* 29(80.56)* WT1: 肾母细胞瘤; FCM-MRD: 流式细胞术检测微小残留病灶。与预后良好组比较, *P<0.05。 表 2 不同方案患儿WT1基因、FCM-MRD阳性率变化及预后良好率比较(x±s)[n(%)]
治疗方案 时点 WT1 FCM-MRD阳性 预后良好 DAH化疗方案(n=35) 治疗前 0.83±0.32 — — 治疗后 0.67±0.31 16(41.03) 19(48.72) DAE化疗方案(n=41) 治疗前 0.85±0.37 — — 治疗后 0.81±0.41 32(60.38) 21(39.62) 表 3 AML患儿临床病理特征与WT1基因表达及FCM-MRD阳性率关系(x±s)[n(%)]
临床特征 n WT1表达 t、F/P FCM-MRD阳性 χ2/P 性别 0.242/0.810 2.056/0.152 男 46 0.78±0.31 32(69.57) 女 30 0.76±0.41 16(53.33) 年龄 -0.120/0.904 1.040/0.308 >5岁 49 0.77±0.36 33(67.35) ≤5岁 27 0.78±0.32 15(55.56) 白细胞计数 -3.374/0.001 6.523/0.011 ≤50×109/L 37 0.64±0.32 18(48.65) >50×109/L 39 0.90±0.35 30(76.92) FAB分型 20.211/<0.001 6.445/0.012 M0 2 0.69±0.33 2(100.00) M1 5 0.68±0.31 2(40.00) M2 23 0.68±0.38 16(69.57) M4 9 0.74±0.34 6(66.67) M5 26 0.79±0.32 15(57.69) M7 11 0.88±0.42 7(63.64) 骨髓原始细胞 -2.643/0.010 6.124/0.013 <50% 43 0.68±0.33 22(51.16) ≥50% 33 0.89±0.36 26(78.79) 细胞遗传学分组 17.234/<0.001 5.667/0.021 良好核型组 29 0.67±0.34 12(41.38) 中等核型组 20 0.71±0.37 19(95.00) 不良核型组 27 0.85±0.36 17(62.96) FAB分型: 法国(France)、美国(American)和英国(Britain)等三国血细胞形态学专家讨论、制订的
关于急性白血病的分型诊断标准。表 4 WT1基因联合FCM-MRD对AML患儿预后的预测效能
指标 曲线下面积 95%CI 敏感度/% 特异度/% 截断值 约登指数 WT1 0.571* 0.452~0.684 41.67 80.00 >0.775 0.217 FCM-MRD 0.751* 0.639~0.843 77.78 72.50 — 0.503 联合诊断 0.882 0.788~0.945 88.89 87.50 — 0.764 与联合诊断比较, *P<0.05。 表 5 WT1基因、FCM-MRD阳性率与FLT3 ITD/TKD突变的相关性分析
指标 FLT3 ITD突变 FLT3 TKD突变 FLT3 ITD/TKD双突变 r P r P r P WT1基因 0.122 0.062 0.221 0.059 0.198 0.060 FCM-MRD阳性率 0.210 0.059 0.111 0.102 0.144 0.078 -
[1] POLLYEA D A, BIXBY D, PERL A, et al. NCCN guidelines insights: acute myeloid leukemia, version 2. 2021[J]. J Natl Compr Canc Netw, 2021, 19(1): 16-27. doi: 10.6004/jnccn.2021.0002
[2] LONG N A, GOLLA U, SHARMA A, et al. Acute myeloid leukemia stem cells: origin, characteristics, and clinical implications[J]. Stem Cell Rev Rep, 2022, 18(4): 1211-1226. doi: 10.1007/s12015-021-10308-6
[3] 吴秀继, 王永卿, 杨晓阳, 等. 急性期蛋白对急性髓系白血病患者预后的预测价值[J]. 中国实验血液学杂志, 2022, 30(4): 1086-1093. [4] ZHAI Y N, SINGH P, DOLNIK A, et al. Longitudinal single-cell transcriptomics reveals distinct patterns of recurrence in acute myeloid leukemia[J]. Mol Cancer, 2022, 21(1): 166. doi: 10.1186/s12943-022-01635-4
[5] AITKEN M J L, RAVANDI F, PATEL K P, et al. Prognostic and therapeutic implications of measurable residual disease in acute myeloid leukemia[J]. J Hematol Oncol, 2021, 14(1): 137. doi: 10.1186/s13045-021-01148-5
[6] VONK C M, AL HINAI A S A, HANEKAMP D, et al. Molecular minimal residual disease detection in acute myeloid leukemia[J]. Cancers, 2021, 13(21): 5431. doi: 10.3390/cancers13215431
[7] TAGA T, TANAKA S, HASEGAWA D, et al. Post-induction MRD by FCM and GATA1-PCR are significant prognostic factors for myeloid leukemia of Down syndrome[J]. Leukemia, 2021, 35(9): 2508-2516. doi: 10.1038/s41375-021-01157-w
[8] CHAPUIS A G, EGAN D N, BAR M, et al. T cell receptor gene therapy targeting WT1 prevents acute myeloid leukemia relapse post-transplant[J]. Nat Med, 2019, 25(7): 1064-1072. doi: 10.1038/s41591-019-0472-9
[9] 王平, 熊昊, 李建新, 等. CCLG-AML-2015方案治疗儿童急性髓系白血病的临床分析[J]. 中国实验血液学杂志, 2022, 30(2): 373-380. [10] 张丽, 邹尧, 艾晓非, 等. 儿童TCF3-PBX1+急性淋巴细胞白血病中微小残留病与预后的相关性[J]. 中国实验血液学杂志, 2020, 28(6): 1831-1836. [11] CREUTZIG U, KASPERS G J L. Revised recommendations of the international working group for diagnosis, standardization of response criteria, treatment outcomes, and reporting standards for therapeutic trials in acute myeloid leukemia[J]. J Clin Oncol, 2004, 22(16): 3432-3433. doi: 10.1200/JCO.2004.99.116
[12] 赵明一, 李嘉华, 江华. 儿童急性髓系白血病造血干细胞移植后复发的预防和治疗[J]. 临床儿科杂志, 2023, 41(3): 167-174. [13] 司君齐, 田晨. 急性髓系白血病细胞与骨髓基质细胞相互作用的研究进展[J]. 中国肿瘤临床, 2023, 50(2): 88-91. [14] 娄典, 刘利, 严学倩, 等. 异基因造血干细胞移植治疗难治/复发急性髓系白血病的疗效及预后因素分析[J]. 中国实验血液学杂志, 2022, 30(5): 1577-1585. [15] PATKAR N, KAKIRDE C, SHAIKH A F, et al. Clinical impact of panel-based error-corrected next generation sequencing versus flow cytometry to detect measurable residual disease (MRD) in acute myeloid leukemia (AML)[J]. Leukemia, 2021, 35(5): 1392-1404. doi: 10.1038/s41375-021-01131-6
[16] AUGSBERGER C, HÄNEL G, XU W, et al. Targeting intracellular WT1 in AML with a novel RMF-peptide-MHC-specific T-cell bispecific antibody[J]. Blood, 2022, 139(13): 2086-2087. doi: 10.1182/blood.2022015672
[17] HAJDU B, HUNYADI-GULYÁS É, KATO K, et al. Zinc binding of a Cys2His2-type zinc finger protein is enhanced by the interaction with DNA[J]. J Biol Inorg Chem, 2023, 28(3): 301-315. doi: 10.1007/s00775-023-01988-1
[18] BELALI T, WODI C, CLARK B, et al. WT1 activates transcription of the splice factor kinase SRPK1 gene in PC3 and K562 cancer cells in the absence of corepressor BASP1[J]. Biochim Biophys Acta Gene Regul Mech, 2020, 1863(12): 194642. doi: 10.1016/j.bbagrm.2020.194642
[19] STEGER B, FLORO L, AMBERGER D C, et al. WT1, PRAME, and PR3 mRNA expression in acute myeloid leukemia (AML)[J]. J Immunother, 2020, 43(6): 204-215. doi: 10.1097/CJI.0000000000000322
[20] KREUTMAIR S, PFEIFER D, WATERHOUSE M, et al. First-in-human study of WT1 recombinant protein vaccination in elderly patients with AML in remission: a single-center experience[J]. Cancer Immunol Immunother, 2022, 71(12): 2913-2928. doi: 10.1007/s00262-022-03202-8
[21] 王卫国. 急性白血病微小残留病检测方法临床应用的研究进展[J]. 山东医药, 2017, 57(38): 110-113. [22] PATKAR N, KAKIRDE C, BHANSHE P, et al. Utility of immunophenotypic measurable residual disease in adult acute myeloid leukemia-real-world context[J]. Front Oncol, 2019, 9: 450. doi: 10.3389/fonc.2019.00450
-
期刊类型引用(2)
1. 谭文涛,李卫东,张美琪,沈玄洋. 血清FGF9、Sestrin2及HBDH与脓毒症严重程度的相关性及对临床转归的预测研究. 临床和实验医学杂志. 2025(01): 21-25 .  百度学术
百度学术
2. 原晨,陈康,张东红,王凤. 美罗培南联合血必净注射液治疗脓毒症并发ARDS的疗效及对血清炎症因子、SIRT、微小RNA的影响. 临床和实验医学杂志. 2025(01): 25-29 .  百度学术
百度学术
其他类型引用(0)




 下载:
下载:



 苏公网安备 32100302010246号
苏公网安备 32100302010246号
