Influence of pulsatilla saponin on proliferation, migrationand invasion of gastric cancer HGC-27 cells and its possible mechanism
-
摘要:目的
探讨白头翁皂苷对胃癌细胞HGC-27增殖、迁移和侵袭的影响及其可能机制。
方法采用不同浓度白头翁皂苷(12.5、25.0、50.0 μmol/L)处理人胃癌细胞HGC-27, 分别设为低白头翁皂苷组、中白头翁皂苷组、高白头翁皂苷组,另将正常培养的HGC-27细胞设为对照组。将si-NC、si-circNRIP1、pcDNA、pcDNA-circNRIP1转染至HGC-27细胞,分别设为si-NC组、si-circNRIP1组、pcDNA组、pcDNA-circNRIP1组。向HGC-27细胞中转染pcDNA、pcDNA-circNRIP1, 均加入50.0 μmol/L白头翁皂苷培养,分别记为白头翁皂苷+pcDNA组、白头翁皂苷+pcDNA-circNRIP1组。通过CCK-8法、平板克隆形成实验和Transwell实验分别检测细胞增殖、克隆形成和迁移、侵袭能力; 采用实时荧光定量聚合酶链反应(qRT-PCR)法检测环状RNA核受体相互作用蛋白1 (circNRIP1)表达量; 采用蛋白质印迹法(Western blot)检测E-钙黏蛋白(E-cadherin)、N-钙黏蛋白(N-cadherin)的蛋白表达情况。
结果对照组、低白头翁皂苷组、中白头翁皂苷组、高白头翁皂苷组细胞增殖抑制率、E-cadherin蛋白水平依次升高,细胞克隆形成数量、迁移数量、侵袭数量依次减少, N-cadherin蛋白水平、circNRIP1表达量依次降低,差异均有统计学意义(P < 0.05); pcDNA-circNRIP1组circNRIP1表达量高于pcDNA组, si-circNRIP1组circNRIP1表达量低于si-NC组,差异有统计学意义(P < 0.05); si-circNRIP1组细胞增殖抑制率和E-cadherin蛋白水平高于si-NC组, N-cadherin蛋白水平低于si-NC组,细胞克隆形成数量、迁移数量和侵袭数量少于si-NC组,差异均有统计学意义(P < 0.05); 白头翁皂苷+pcDNA-circNRIP1组细胞增殖抑制率和E-cadherin蛋白水平低于白头翁皂苷+pcDNA组, N-cadherin蛋白水平高于白头翁皂苷+pcDNA组,细胞克隆形成数量、迁移数量和侵袭数量多于白头翁皂苷+pcDNA组,差异有统计学意义(P < 0.05)。
结论白头翁皂苷可抑制胃癌细胞增殖、迁移、侵袭活性且呈现浓度依赖性,其作用机制或与下调circNRIP1表达有关。
Abstract:ObjectiveTo explore the influence of pulsatilla saponin on proliferation, migration and invasion of gastric cancer HGC-27 cells and its possible mechanism.
MethodsHuman gastric cancer HGC-27 cells were treated with different doses of pulsatilla saponin (12.5, 25.0, 50.0 μmol/L) and named as low-dose pulsatilla saponin group, medium-dose pulsatilla saponin group and high-dose pulsatilla saponin group, and the normal cultured HGC-27 cells were named as control group. The si-NC, si-circNRIP1, pcDNA and pcDNA-circNRIP1 were transfected into HGC-27 cells, and were named as si-NC group, si-circNRIP1 group, pcDNA group and pcDNA-circNRIP1 group respectively. HGC-27 cells were transfected with pcDNA and pcDNA-circNRIP1 and cultured with 50.0 μmol/L pulsatilla saponin, and were named as pulsatilla saponin plus pcDNA group and pulsatilla saponin plus pcDNA-circNRIP1 group respectively. CCK-8 assay, colony formation assay and Transwell assay were used to detect the proliferation, clone formation and migration, and invasion respectively; quantitative real-time polymerase chain reaction (qRT-PCR) was used to detect the expression of circular RNA nuclear receptor interacting protein 1 (circNRIP1); Western blot was used to detect the expressions of E-cadherin and N-cadherin proteins.
ResultsIn the control group, low-dose pulsatilla saponin group, medium-dose pulsatilla saponin group and high-dose pulsatilla saponin group, the inhibition rates of cell proliferation and the levels of E-cadherin protein significantly increased gradually, the number of cell clone formation, migration and invasion significantly decreased gradually, and the expressions of N-cadherin protein and circNRIP1 significantly decreased gradually (P < 0.05); the expression level of circNRIP1 in the pcDNA-circNRIP1 group was significantly higher than that in the pcDNA group, while the expression level of circNRIP1 in the si-circNRIP1 group was significantly lower than thatin the si-NC group (P < 0.05); the inhibition rate of cell proliferation and level of E-cadherin protein in the si-circNRIP1 group were significantly higher than those in the si-NC group, while the level of N-cadherin protein and the number of cell clone formation, migration and invasion were significantly lower than those in the si-NC group (P < 0.05); the inhibition rate of cell proliferation and level of E-cadherin protein in the pulsatilla saponin plus pcDNA-circNRIP1 group were significantly lower than those in the pulsatilla saponin plus pcDNA group, while the level of N-cadherin protein and the number of cell clone formation, migration and invasion were significantly higher than those in the pulsatilla saponin plus pcDNA group (P < 0.05).
ConclusionPulsatilla saponin can inhibit the proliferation, migration and invasion of gastric cancer cells in a dose-dependent manner, and its mechanism may be associated with down-regulation of circNRIP1 expression.
-
胃癌是临床常见的恶性肿瘤,目前多采用手术结合放化疗方式进行治疗,但部分患者因产生耐药性或放射抵抗性而疗效欠佳,故寻找安全有效的治疗药物对改善患者预后具有重要意义[1-2]。相关研究[3-4]将中草药用于胃癌的治疗中,发现其可通过影响胃癌细胞生物学行为而减缓胃癌发展进程。白头翁属于毛茛科植物白头翁的干燥根,具有抗炎、抗肿瘤作用。研究[5]表明,白头翁皂苷类化合物具有抗肿瘤作用,但白头翁皂苷对胃癌细胞生物学行为的影响尚不明确。环状RNA(circRNA)是由5′端与3′端以共价键结合形成的闭合RNA分子,在胃癌等肿瘤中表达异常且具有高稳定性。环状RNA核受体相互作用蛋白1 (circNRIP1)作为circRNA成员之一,能通过调控细胞外信号调节激酶1/2(ERK1/2)、磷脂酰肌醇3激酶(PI3K)/蛋白激酶B(Akt)以及Akt/哺乳动物雷帕霉素靶蛋白(mTOR)信号通路介导肿瘤细胞的发展[6]。研究[7]表明,胃癌细胞中circNRIP1表达水平增高,下调circNRIP1可促进胃癌细胞凋亡。另有研究[8]指出, circNRIP1高表达与胃癌的转移潜力和复发风险密切相关。此外, circNRIP1可通过调控葡萄糖代谢而参与胃癌发生过程[9]。本研究探讨白头翁皂苷对胃癌细胞增殖、迁移和侵袭的影响,并分析其机制是否与调控circNRIP1有关,以期为胃癌的临床治疗提供新的方向与思路。
1. 材料与方法
1.1 材料与试剂
人胃癌细胞HGC-27购自中国科学院典型培养物保藏委员会细胞库; 白头翁皂苷购自南京春秋生物科技有限公司(纯度≥98%); DMEM培养液与胎牛血清购自美国Gibco公司; Trizol试剂由上海源叶生物公司提供; LipofectamineTM3000 Transfection Reagent转染试剂由北京普利莱公司提供; 反转录和荧光定量聚合酶链反应(PCR)试剂盒购自北京天根生化; pcDNA、pcDNA-circNRIP1购自上海吉满生物; si-NC、si-circNRIP1由广州锐博生物公司提供; 兔抗人E-钙黏蛋白(E-cadherin)、N-钙黏蛋白(N-cadherin)抗体均由北京普利莱基因技术有限公司提供; CCK-8试剂、Transwell小室、Matrigel基质胶均由北京索莱宝科技有限公司提供; GAPDH抗体、带有辣根过氧化物酶(HRP)标记的山羊抗兔免疫球蛋白G(IgG)二抗均购于上海翌圣生物公司。
1.2 方法
1.2.1 实验分组:
将HGC-27细胞种植于6孔细胞培养板中,加入不同浓度白头翁皂苷(12.5、25.0、50.0 μmol/L)培养24 h[10], 分别设为低白头翁皂苷组、中白头翁皂苷组、高白头翁皂苷组,另将正常培养的HGC-27细胞设为对照组。采用脂质体转染法将si-NC、si-circNRIP1转染至HGC-27细胞,分别设为si-NC组、si-circNRIP1组。采用脂质体转染法将pcDNA-circNRIP1、pcDNA转染至HGC-27细胞,分别设为pcDNA-circNRIP1组、pcDNA组。分别向HGC-27细胞中转染pcDNA、pcDNA-circNRIP1, 然后将50.0 μmol/L白头翁皂苷加至细胞中培养24 h, 分别记为白头翁皂苷+pcDNA组、白头翁皂苷+pcDNA-circNRIP1组。
1.2.2 CCK-8法检测细胞增殖能力:
将收集好的各组HGC-27细胞置入96孔板中,每孔均加入CCK-8溶液10 μL, 置入恒温培育箱中持续培育2 h, 使用酶标仪检测各孔450 nm处光密度(OD)值并记录数据。
1.2.3 平板克隆形成实验检测细胞克隆形成能力:
将各组HGC-27细胞以每孔500个分别接种于6孔板中,继续培育至出现肉眼可见的细胞克隆团,弃培养基并加入500 μL甲醇,持续固定20 min后加入浓度1%的结晶紫染色液400 μL, 持续染色15 min, 拍照并观察细胞克隆情况。
1.2.4 Transwell实验检测细胞迁移和侵袭能力:
① 侵袭实验。收集各组HGC-27细胞,在加入稀释的Matrigel基质胶的上室进行接种(每孔1×105个),并将600 μL血清培养液置入其下室,共同置入培育箱,持续48 h后,弃去培养液,加入4%浓度的多聚甲醛完成固定,时间20 min, 然后用1%浓度结晶紫染色液染色10 min, 再用显微镜观察细胞侵袭情况。②迁移实验。收集各组HGC-27细胞接种于上室(每孔1×105个),后续实验步骤同侵袭实验。
1.2.5 实时荧光定量聚合酶链反应(qRT-PCR)法检测circNRIP1表达:
向各组HGC-27细胞中加入1 mL Trizol试剂,有效提取细胞总DNA, 各组DNA浓度测定均采用紫外分光光度计完成。建立反转录体系,分别为5×g DNA Buffer 2 μL, 2 μL 10×King RT Buffer, 1 μL FastKing RT Enzyme Mix, 2 μL FQ-RT Primer Mix, 2 μg RNA, 并将20 μL RNase-Free ddH2O作为补足体系。qRT-PCR扩增操作在cDNA模板基础上进行。使用罗氏LightCycler480荧光定量PCR仪检测circNRIP1相对表达量。
1.2.6 蛋白质印迹法(Western blot)检测E-cadherin、N-cadherin蛋白表达:
将RIPA裂解液分别加入各组HGC-27细胞中,提取细胞总蛋白后,采用二喹啉甲酸(BCA)方法分别检测相关蛋白浓度。采用十二烷基硫酸钠-聚丙烯酰胺凝胶电泳(SDS-PAGE)方法对40 μg蛋白进行电泳操作,并将分离好的蛋白凝胶转至聚偏氟乙烯(PVDF)膜,加入5%浓度的脱脂牛奶进行封闭操作,持续时间2 h; 将E-cadherin一抗(1∶1 000稀释)、N-cadherin一抗(1∶1 000稀释)和内参GAPDH抗体(1∶3 000稀释)与PVDF膜共同在4 ℃环境下孵育一夜,再将膜继续与二抗(1∶5 000稀释)在37 ℃恒温环境中孵育2 h, 应用Quantity One软件对蛋白条带进行定量分析。
1.3 统计学分析
采用SPSS 21.0统计学软件分析数据,计量资料以(x±s)表示, 2组间比较采用独立样本t检验,多组间比较采用单因素方差分析, P < 0.05为差异有统计学意义。
2. 结果
2.1 白头翁皂苷对HGC-27细胞增殖能力和克隆形成能力的影响
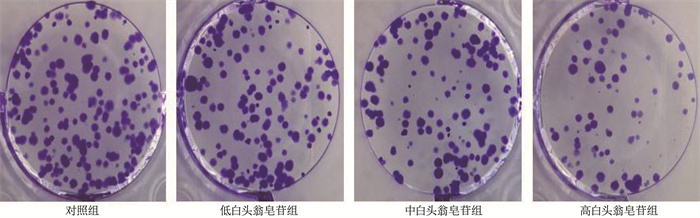
对照组、低白头翁皂苷组、中白头翁皂苷组、高白头翁皂苷组细胞增殖抑制率依次升高,细胞克隆形成数量依次减少,差异均有统计学意义(P < 0.05)。见表 1、图 1。
表 1 4组细胞增殖抑制率和细胞克隆形成数量比较(x±s)组别 n 细胞增殖抑制率/% 细胞克隆形成数量/个 对照组 9 0±0 103.89±6.92 低白头翁皂苷组 9 10.50±1.06* 85.56±3.50* 中白头翁皂苷组 9 23.51±1.29*# 63.11±2.85*# 高白头翁皂苷组 9 44.71±2.37*#△ 42.44±2.31*#△ 与对照组比较, *P < 0.05; 与低白头翁皂苷组比较, #P < 0.05; 与中白头翁皂苷组比较, △P < 0.05。 2.2 白头翁皂苷对HGC-27细胞迁移、侵袭能力的影响
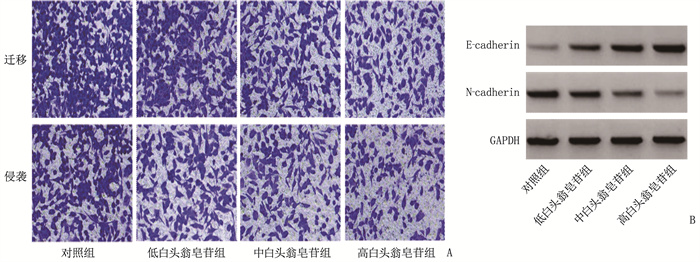
对照组、低白头翁皂苷组、中白头翁皂苷组、高白头翁皂苷组细胞迁移数量、侵袭数量依次减少, N-cadherin蛋白表达依次降低, E-cadherin蛋白表达依次升高,差异均有统计学意义(P < 0.05), 见图 2、表 2。
表 2 4组细胞迁移、侵袭数量和E-cadherin、N-cadherin蛋白表达情况比较(x±s)组别 n 迁移数量/个 侵袭数量/个 E-钙黏蛋白 N-钙黏蛋白 对照组 9 221.56±11.92 163.00±7.27 0.22±0.03 0.89±0.06 低白头翁皂苷组 9 182.00±7.42* 132.67±5.12* 0.38±0.04* 0.64±0.05* 中白头翁皂苷组 9 149.78±6.41*# 98.00±4.35*# 0.56±0.06*# 0.43±0.04*# 高白头翁皂苷组 9 105.11±5.13*#△ 70.33±3.53*#△ 0.77±0.06*#△ 0.21±0.02*#△ 与对照组比较, *P < 0.05; 与低白头翁皂苷组比较, #P < 0.05; 与中白头翁皂苷组比较, △P < 0.05。 2.3 白头翁皂苷对HGC-27细胞中circNRIP1表达的影响
对照组、低白头翁皂苷组、中白头翁皂苷组、高白头翁皂苷组circNRIP1表达量依次降低,差异均有统计学意义(P < 0.05), 见表 3。
表 3 4组细胞circNRIP1表达量比较(x±s)组别 n circNRIP1 对照组 9 1.00±0 低白头翁皂苷组 9 0.71±0.05* 中白头翁皂苷组 9 0.48±0.05*# 高白头翁皂苷组 9 0.22±0.02*#△ circNRIP1: 环状RNA核受体相互作用蛋白1。与对照组比较, *P < 0.05; 与低白头翁皂苷组比较, #P < 0.05; 与中白头翁皂苷组比较, △P < 0.05。 2.4 过表达和抑制circNRIP1后circNRIP1转染效率检测结果
与pcDNA组比较, pcDNA-circNRIP1组circNRIP1表达量升高,差异有统计学意义(P < 0.05); 与si-NC组比较, si-circNRIP1组circNRIP1表达量降低,差异有统计学意义(P < 0.05)。见表 4。
表 4 各组circNRIP1转染效率检测结果比较(x±s)组别 n circNRIP1 pcDNA组 9 1.00±0 pcDNA-circNRIP1组 9 2.71±0.10* si-NC组 9 1.00±0 si-circNRIP1组 9 0.46±0.05# 与pcDNA组比较, *P < 0.05; 与si-NC组比较, #P < 0.05。 2.5 抑制circNRIP1对HGC-27细胞增殖、迁移、侵袭的影响
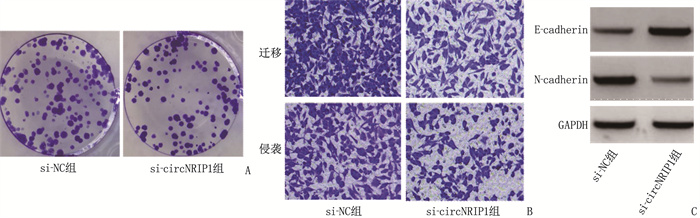
si-circNRIP1组细胞增殖抑制率和E-cadherin蛋白水平高于si-NC组, N-cadherin蛋白水平低于si-NC组,细胞克隆形成数量、迁移数量和侵袭数量少于si-NC组,差异均有统计学意义(P < 0.05), 见图 3、表 5。
表 5 抑制circNRIP1对HGC-27细胞增殖、迁移、侵袭相关指标的影响(x±s)组别 n 细胞增殖抑制率/% 细胞克隆形成数量/个 迁移数量/个 侵袭数量/个 E-cadherin蛋白水平 N-cadherin蛋白水平 si-NC组 9 0±0 102.56±9.27 218.00±10.31 165.00±11.22 0.21±0.03 0.85±0.07 si-circNRIP1组 9 36.38±2.15* 53.11±2.88* 125.00±8.03* 85.78±5.53* 0.64±0.06* 0.32±0.03* 与si-NC组比较, *P < 0.05。 2.6 过表达circNRIP1对白头翁皂苷处理的HGC-27细胞增殖、迁移、侵袭的影响
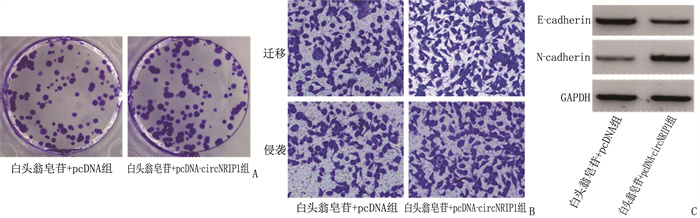
白头翁皂苷+pcDNA-circNRIP1组细胞增殖抑制率和E-cadherin蛋白水平低于白头翁皂苷+pcDNA组, N-cadherin蛋白水平高于白头翁皂苷+pcDNA组,细胞克隆形成数量、迁移数量和侵袭数量多于白头翁皂苷+pcDNA组,差异有统计学意义(P < 0.05), 见图 4、表 6。
表 6 过表达circNRIP1对白头翁皂苷处理的HGC-27细胞增殖、迁移、侵袭相关指标的影响(x±s)组别 n 细胞增殖抑制率/% 细胞克隆形成数量/个 迁移数量/个 侵袭数量/个 E-cadherin蛋白水平 N-cadherin蛋白水平 白头翁皂苷+pcDNA组 9 44.36±1.94 41.89±3.14 106.44±7.24 72.00±4.97 0.76±0.07 0.19±0.03 白头翁皂苷+pcDNA-circNRIP1组 9 15.53±1.20* 79.44±2.71* 162.11±9.47* 114.56±6.24* 0.41±0.05* 0.53±0.05* 与白头翁皂苷+pcDNA组比较, *P < 0.05。 3. 讨论
既往研究[11]显示, circRNA在胃癌组织和相关细胞系中异常表达,且对胃癌细胞生物学行为产生一定影响,例如环状RNA人抗原R(circ-HuR, hsa_circ_0049027)在胃癌组织和细胞系中表达下调,上调其表达则可抑制胃癌细胞生长、侵袭和转移,机制可能是circ-HuR与CCHC型锌指核酸结合蛋白(CNBP)相互作用并抑制人抗原R(HuR)表达,进而抑制肿瘤进展。胃癌组织和患者血清中的环状RNA SH3结构域激酶结合蛋白1(circSHKBP1, hsa_circ_0000936)表达均增加,且其与较高的TNM分期和较低的存活率有关, circSHKBP1过表达可促进胃癌细胞增殖、迁移、侵袭、血管生成,并充当微小RNA-582-3p(miR-582-3p)的海绵分子增加HuR表达,还可与热休克蛋白90(HSP90)结合,抑制HSP90泛素化,促进胃癌发展[12]。
从天然植物中提取的活性成分如齐墩果酸具有抗胃癌作用,其机制可能与调控相关信号通路表达有关[13]。研究[14]显示,白头翁皂苷能抑制肺癌细胞增殖并促进细胞凋亡。另有研究[15]报道,白头翁皂苷可抑制结直肠癌细胞增殖及糖酵解。本研究结果显示,随着白头翁皂苷浓度的升高,胃癌细胞增殖抑制率升高,细胞克隆形成数量减少,提示白头翁皂苷可抑制胃癌细胞增殖且具有浓度依赖性。E-cadherin、N-cadherin为上皮-间质转化(EMT)相关标志物,若两者表达失调,可促进EMT, 进而促进细胞迁移与侵袭[16-17]。本研究发现,白头翁皂苷以浓度依赖性方式抑制胃癌细胞迁移与侵袭,并上调E-cadherin蛋白表达和下调N-cadherin蛋白表达,提示白头翁皂苷可在一定程度上抑制胃癌细胞迁移与侵袭活性。
circNRIP1在胃癌组织或细胞系中表达水平升高,敲低circNRIP1可抑制胃癌细胞增殖、迁移、侵袭和丝氨酸/苏氨酸激酶1(AKT1)表达,微小RNA-149-5p(miR-149-5p)过表达可减弱circNRIP1对胃癌细胞生物学行为的影响,同时circNRIP1可充当miR-149-5p海绵分子而影响AKT1表达,进而促进胃癌发生与发展[8]。circNRIP1在抗紫杉醇(PTX)的卵巢癌组织和细胞中高表达,沉默circNRIP1可抑制卵巢癌细胞PTX抗性, circNRIP1可充当微小RNA-211-5p(miR-211-5p)海绵分子,抑制miR-211-5p表达可减弱沉默circNRIP1对卵巢癌细胞PTX抗性的抑制作用, miR-211-5p靶向结合同源框C8(HOXC8), HOXC8过表达可减弱miR-211-5p对卵巢癌细胞PTX抗性的抑制作用,circNRIP1、miR-211-5p可共同调节HOXC8表达[18]。circNRIP1在宫颈癌组织、细胞中表达上调,其表达与淋巴血管间隙浸润相关,可促进宫颈癌细胞增殖、迁移、侵袭,微小RNA-629-3p(miR-629-3p)通过调节蛋白酪氨酸磷酸酶4A1(PTP4A1)、ERK1/2抑制宫颈癌细胞增殖与转移, circNRIP1可通过充当miR-629-3p的海绵分子而调节PTP4A1/ERK1/2通路, circNRIP1可能成为宫颈癌的潜在治疗靶点[19]。本研究结果显示,经白头翁皂苷处理后,胃癌细胞circNRIP1表达量降低,提示白头翁皂苷可能通过抑制circNRIP1而发挥抗胃癌进展作用。本研究进一步验证circNRIP1可否作为白头翁皂苷治疗胃癌的潜在靶点,结果显示,抑制circNRIP1表达可减弱胃癌细胞增殖、克隆形成、迁移和侵袭能力,而过表达circNRIP1可拮抗白头翁皂苷对胃癌细胞生长与转移的抑制作用。由此提示,白头翁皂苷对circNRIP1表达具有调控作用,并通过这一机制降低胃癌细胞生长与转移活性。
综上所述,白头翁皂苷对胃癌细胞增殖、迁移、侵袭活性具有明显抑制作用且呈现浓度依赖性,其作用机制与抑制circNRIP1表达有关。circNRIP1或可成为白头翁皂苷治疗胃癌的潜在靶点,这为白头翁皂苷对胃癌调控机制的研究提供了一定的理论依据。
-
表 1 4组细胞增殖抑制率和细胞克隆形成数量比较(x±s)
组别 n 细胞增殖抑制率/% 细胞克隆形成数量/个 对照组 9 0±0 103.89±6.92 低白头翁皂苷组 9 10.50±1.06* 85.56±3.50* 中白头翁皂苷组 9 23.51±1.29*# 63.11±2.85*# 高白头翁皂苷组 9 44.71±2.37*#△ 42.44±2.31*#△ 与对照组比较, *P < 0.05; 与低白头翁皂苷组比较, #P < 0.05; 与中白头翁皂苷组比较, △P < 0.05。 表 2 4组细胞迁移、侵袭数量和E-cadherin、N-cadherin蛋白表达情况比较(x±s)
组别 n 迁移数量/个 侵袭数量/个 E-钙黏蛋白 N-钙黏蛋白 对照组 9 221.56±11.92 163.00±7.27 0.22±0.03 0.89±0.06 低白头翁皂苷组 9 182.00±7.42* 132.67±5.12* 0.38±0.04* 0.64±0.05* 中白头翁皂苷组 9 149.78±6.41*# 98.00±4.35*# 0.56±0.06*# 0.43±0.04*# 高白头翁皂苷组 9 105.11±5.13*#△ 70.33±3.53*#△ 0.77±0.06*#△ 0.21±0.02*#△ 与对照组比较, *P < 0.05; 与低白头翁皂苷组比较, #P < 0.05; 与中白头翁皂苷组比较, △P < 0.05。 表 3 4组细胞circNRIP1表达量比较(x±s)
组别 n circNRIP1 对照组 9 1.00±0 低白头翁皂苷组 9 0.71±0.05* 中白头翁皂苷组 9 0.48±0.05*# 高白头翁皂苷组 9 0.22±0.02*#△ circNRIP1: 环状RNA核受体相互作用蛋白1。与对照组比较, *P < 0.05; 与低白头翁皂苷组比较, #P < 0.05; 与中白头翁皂苷组比较, △P < 0.05。 表 4 各组circNRIP1转染效率检测结果比较(x±s)
组别 n circNRIP1 pcDNA组 9 1.00±0 pcDNA-circNRIP1组 9 2.71±0.10* si-NC组 9 1.00±0 si-circNRIP1组 9 0.46±0.05# 与pcDNA组比较, *P < 0.05; 与si-NC组比较, #P < 0.05。 表 5 抑制circNRIP1对HGC-27细胞增殖、迁移、侵袭相关指标的影响(x±s)
组别 n 细胞增殖抑制率/% 细胞克隆形成数量/个 迁移数量/个 侵袭数量/个 E-cadherin蛋白水平 N-cadherin蛋白水平 si-NC组 9 0±0 102.56±9.27 218.00±10.31 165.00±11.22 0.21±0.03 0.85±0.07 si-circNRIP1组 9 36.38±2.15* 53.11±2.88* 125.00±8.03* 85.78±5.53* 0.64±0.06* 0.32±0.03* 与si-NC组比较, *P < 0.05。 表 6 过表达circNRIP1对白头翁皂苷处理的HGC-27细胞增殖、迁移、侵袭相关指标的影响(x±s)
组别 n 细胞增殖抑制率/% 细胞克隆形成数量/个 迁移数量/个 侵袭数量/个 E-cadherin蛋白水平 N-cadherin蛋白水平 白头翁皂苷+pcDNA组 9 44.36±1.94 41.89±3.14 106.44±7.24 72.00±4.97 0.76±0.07 0.19±0.03 白头翁皂苷+pcDNA-circNRIP1组 9 15.53±1.20* 79.44±2.71* 162.11±9.47* 114.56±6.24* 0.41±0.05* 0.53±0.05* 与白头翁皂苷+pcDNA组比较, *P < 0.05。 -
[1] 沈乃营, 鲁峰刚, 张毅, 等. 胃癌组织中Foxp3+Tregs和pDCs与胃微生物群失调的关系[J]. 解剖学研究, 2021, 43(5): 503-507, 513. https://www.cnki.com.cn/Article/CJFDTOTAL-GDJP202105006.htm [2] 李沙沙, 李绪露. GAS5基因启动子甲基化在老年胃癌组织中的水平及其与临床病理特征的相关性[J]. 解剖学研究, 2019, 41(4): 278-281. https://www.cnki.com.cn/Article/CJFDTOTAL-GDJP201904009.htm [3] LIU Z M, YANG X L, JIANG F, et al. Matrine involves in the progression of gastric cancer through inhibiting miR-93-5p and upregulating the expression of target gene AHNAK[J]. J Cell Biochem, 2020, 121(3): 2467-2477. doi: 10.1002/jcb.29469
[4] ZHOU Y, XU Q H, SHANG J J, et al. Crocin inhibits the migration, invasion, and epithelial-mesenchymal transition of gastric cancer cells via miR-320/KLF5/HIF-1α signaling[J]. J Cell Physiol, 2019, 234(10): 17876-17885. doi: 10.1002/jcp.28418
[5] 官紫祎, 陈兰英, 罗颖颖, 等. 基于糖酵解机制的白头翁皂苷多成分协同抑制人肺癌NCI-H460细胞增殖作用研究[J]. 中草药, 2019, 50(21): 5289-5297. https://www.cnki.com.cn/Article/CJFDTOTAL-ZCYO201921023.htm [6] DU Z. CircNRIP1: An emerging star in multiple cancers[J]. Pathol Res Pract, 2023, 241: 154281. doi: 10.1016/j.prp.2022.154281
[7] LIANG L, LI L. Down-regulation of circNRIP1 promotes the apoptosis and inhibits the migration and invasion of gastric cancer cells by miR-182/ROCK1 axis[J]. Onco Targets Ther, 2020, 13: 6279-6288. doi: 10.2147/OTT.S221633
[8] ZHANG X, WANG S, WANG H X, et al. Circular RNA circNRIP1 acts as a microRNA-149-5p sponge to promote gastric cancer progression via the AKT1/mTOR pathway[J]. Mol Cancer, 2019, 18(1): 20. doi: 10.1186/s12943-018-0935-5
[9] XU G S, LI M L, WU J, et al. Circular RNA circNRIP1 sponges microRNA-138-5p to maintain hypoxia-induced resistance to 5-fluorouracil through HIF-1α-dependent glucose metabolism in gastric carcinoma[J]. Cancer Manag Res, 2020, 12: 2789-2802. doi: 10.2147/CMAR.S246272
[10] 薛淑一. 白头翁皂苷B4通过Notch通路对肝癌的抑制作用及其机制研究[D]. 青岛: 青岛大学, 2019. [11] YANG F, HU A P, LI D, et al. Circ-HuR suppresses HuR expression and gastric cancer progression by inhibiting CNBP transactivation[J]. Mol Cancer, 2019, 18(1): 158. doi: 10.1186/s12943-019-1094-z
[12] XIE M Y, YU T, JING X M, et al. Exosomal circSHKBP1 promotes gastric cancer progression via regulating the miR-582-3p/HUR/VEGF axis and suppressing HSP90 degradation[J]. Mol Cancer, 2020, 19(1): 112. doi: 10.1186/s12943-020-01208-3
[13] LI Y Y, XU Q F, YANG W, et al. Oleanolic acid reduces aerobic glycolysis-associated proliferation by inhibiting yes-associated protein in gastric cancer cells[J]. Gene, 2019, 712: 143956-143966. doi: 10.1016/j.gene.2019.143956
[14] 官紫祎, 陈兰英, 罗颖颖, 等. 白头翁皂苷对NCI-H460细胞增殖、凋亡的影响及其差异表达蛋白筛选[J]. 中国实验方剂学杂志, 2019, 25(18): 49-56. https://www.cnki.com.cn/Article/CJFDTOTAL-ZSFX201918008.htm [15] 陈兰英, 周朦静, 崔亚茹, 等. 白头翁皂苷干预糖酵解途径抑制SW480人结直肠癌细胞增殖作用研究[J]. 中药材, 2019, 42(3): 652-656. https://www.cnki.com.cn/Article/CJFDTOTAL-ZYCA201903038.htm [16] XU E, XIA X F, JIANG C Y, et al. GPER1 silencing suppresses the proliferation, migration, and invasion of gastric cancer cells by inhibiting PI3K/AKT-mediated EMT[J]. Front Cell Dev Biol, 2020, 8: 591239.
[17] JIANG Y, WANG W, WU X, et al. Pizotifen inhibits the proliferation and invasion of gastric cancer cells[J]. Exp Ther Med, 2020, 19(2): 817-824.
[18] LI M, CAI J, HAN X, et al. Downregulation of circNRIP1 suppresses the paclitaxel resistance of ovarian cancer via regulating the miR-211-5p/HOXC8 axis[J]. Cancer Manag Res, 2020, 12: 9159-9171.
[19] LI X H, MA N Y, ZHANG Y, et al. Circular RNA circNRIP1 promotes migration and invasion in cervical cancer by sponging miR-629-3p and regulating the PTP4A1/ERK1/2 pathway[J]. Cell Death Dis, 2020, 11(5): 399.
-
期刊类型引用(1)
1. 韩明,张梦圆,郑沁薇,张楠,李富龙,方盛泉. 中药调控circRNAs及相关ceRNA网络治疗胃癌研究进展. 上海中医药杂志. 2024(04): 86-91 .  百度学术
百度学术
其他类型引用(0)




 下载:
下载:
 苏公网安备 32100302010246号
苏公网安备 32100302010246号
