Vitamin C alleviates macular degeneration in rats by regulating function of macrophages
-
摘要:目的
探讨维生素C通过调节巨噬细胞功能缓解大鼠黄斑变性的可能机制。
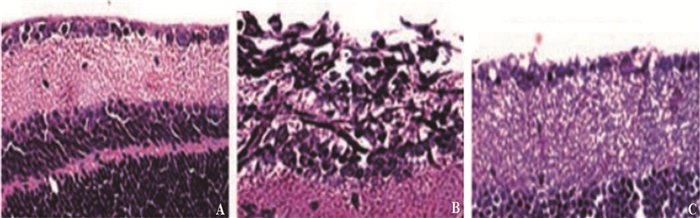
方法应用尾静脉注射碘酸钠法建立黄斑变性SD大鼠模型,并灌胃维生素C对其进行治疗。30只SD大鼠适应性喂养1周后,随机分为正常组、模型组、治疗组,每组10只。正常组不给予处理;治疗组尾静脉注射40 mg/kg碘酸钠造模,实验开始后每天灌胃1次维生素C,灌胃剂量100 mg/kg; 模型组尾静脉注射40 mg/kg碘酸钠造模,实验开始后每天灌胃等体积生理盐水。治疗结束后,使用视网膜电图记录系统检测大鼠视网膜电位,使用苏木精-伊红染色法(HE染色法)对视网膜结构、视网膜外核层细胞数、视网膜色素细胞上皮层进行观察,使用流式细胞仪检测视网膜巨噬细胞的CD36和CD206。
结果维生素C能够减缓大鼠视网膜损伤。模型组视网膜外核层细胞数为(72.90±15.60)个/视野,低于治疗组的(126.40±13.60)个/视野,差异有统计学意义(P<0.01); 模型组视网膜色素上皮细胞层数为(1.56±0.93)层/视野,低于治疗组的(3.49±0.88)层/视野,差异有统计学意义(P<0.05)。维生素C能提高年龄相关性黄斑变性(AMD)大鼠视网膜电位,保护大鼠视网膜功能,缓解AMD进展。维生素C能够提高CD36阳性细胞比率,降低CD206阳性细胞比率,体现为模型组视网膜巨噬细胞CD36阳性细胞比率为(33.98±6.86)%, 低于治疗组的(46.86±3.83)%, 差异有统计学意义(P<0.01); 模型组视网膜巨噬细胞CD206阳性细胞比率为(43.59±6.51)%, 高于治疗组的(31.52±4.08)%, 差异有统计学意义(P<0.01)。
结论维生素C通过增强视网膜巨噬细胞吞噬能力、抑制巨噬细胞M2极化发挥缓解大鼠黄斑变性的功效。
Abstract:ObjectiveTo explore the possible mechanism of vitamin C in alleviating macular degeneration in rats by regulating the function of macrophages.
MethodsSD rats were injected with sodium iodate into the tail vein to create a macular degeneration model, and vitamin C was given to the rats by gavage. Thirty SD rats were randomly divided into normal group, model group and treatment group after adaptive feeding for one week, with 10 rats in each group. The normal group was not given any treatment measures; in the treatment group, 40 mg/kg sodium iodate was injected into the tail vein to establish the model, and 100 mg/kg vitamin C was given by gavage once a day after the start of experiment; in the model group, 40 mg/kg sodium iodate was injected into the tail vein to establish the model, and the equal volume of normal saline was given by gavage every day after the start of experiment. After the treatment, the electroretinogram recording system was used to detect retinal potential of rats, the retinal structure, the number of retinal external nuclear cells and the epithelial layer of retinal pigment cells were detected by hematoxylin-eosin staining (HE staining), and flow cytometry was used to detect CD36 and CD206 in retinal macrophages.
ResultsVitamin C was able to alleviate the retinal damage in rats. The number of retinal external nuclear cells in the model group was (72.90±15.60) cells per field of vision, which was lower than (126.40±13.60) cells per field of vision in the treatment group (P < 0.01). The epithelial layer of retinal pigment cells in the model group was (1.56±0.93) layers per field of vision, which was significantly lower than (3.49±0.88) layers per field of vision in the treatment group (P < 0.05). Vitamin C was able to increase the retinal potential of age-related macular degeneration (AMD) rats, protect the retinal function of rats, and alleviate the progression of AMD. Vitamin C was able to increase the ratio of CD36 positive cells and reduce the ratio of CD206 positive cells, which was reflected as follows: the ratio of CD36 positive cells of retinal macrophages in the model group was (33.98±6.86)%, which was significantly lower than (46.86±3.83)% in the treatment group (P < 0.01). The ratio of CD206 positive cells of retinal macrophages in the model group was (43.59±6.51)%, which was significantly higher than (31.52±4.08)% in the treatment group (P < 0.01).
ConclusionVitamin C can alleviate macular degeneration in rats by enhancing phagocytic capacity of retinal macrophages and inhibiting M2 polarization of macrophages.
-
Keywords:
- vitamin C /
- age-related macular degeneration /
- macrophages /
- electroretinogram /
- retinal damage
-
卵圆孔未闭是一种先天性心脏病,在成年人群中发病率为35%[1], 可引起脑血管疾病。心房颤动(房颤)是一种心脏无序颤动的表现,老年人发病率可达10%以上[2]。当出现房颤时,患者的左心耳收缩功能、排空速度均会出现异常,导致血流速度缓慢,引起左心耳血栓。血栓脱落后会到达左房,由左房到达左室,并随着动脉血到主动脉及其分支,进而引发多种脑栓塞性疾病,威胁患者生命安全[3-4]。卵圆孔未闭合并房颤患者的心脑血管疾病发生风险较高,需及时诊断并治疗。经食道超声心动图是一种通过将超声探头置于食管内进行检查的方法,探头紧邻心脏和近心大血管,检查时能够获得较为清晰的图像,其临床诊断正确率较高[5]。本研究采用食管超声心动图对卵圆孔未闭合并房颤患者进行检查,评估其左心耳容积及功能的变化,现报告如下。
1. 资料与方法
1.1 一般资料
选取2020年12月—2022年12月就诊的80例卵圆孔未闭患者作为研究对象,根据是否合并房颤分为房颤组(n=44)和非房颤组(n=36)。纳入标准: ①知情同意本研究者; ②年龄≤75岁者; ③临床诊断为卵圆孔未闭合[6]者; ④临床表现与健康人群无显著差异者。排除标准: ①伴严重心脏瓣膜病、心肌病及心律失常者; ②中度及以上肺动脉高压者; ③有食管静脉曲张、食管狭窄畸形等上消化道疾病者; ④先天性心脏病患者; ⑤持续咳嗽不适行食道超声心动图检查者; ⑥严重脏器功能不全患者; ⑦有食管手术或纵隔放射治疗史患者。另选取同期检查的健康人群30例作为对照组。本研究通过伦理委员会审核。
1.2 方法
1.2.1 采集图像
采用GE飞利浦EPIQ 7C彩色多普勒超声诊断仪,(经胸探头型号M5S, 频率为1.7~3.5 MHz; 经食道探头型号6VT, 频率为2.0~7.0 MHz), 仪器内配备有EchoPAC图像处理分析软件。先行常规的经胸超声心动图检查,将探头放于胸骨旁,调整探头角度,显示左心耳长轴切面及左心耳口横切面,在左心耳长轴切面及左心耳口横切面测量左房内径(LAD)水平。然后再对患者进行经食道超声心动图检查,首先嘱咐患者口服10 mL盐酸达克罗宁胶浆对口咽部黏膜局部麻醉。采用经食道超声探头插于食管中段,深度约为30 cm, 旋转180°获得完整连续的扫描图像,清晰显示左心耳二维结构后,储存左心耳二维图像待分析,然后启动3D ZOOM, 使2个互相垂直的二维图像完全包括左房耳目标区域,然后再次启动3D ZOOM获取左心耳的三维图像,并存取实时三维动态图像[7](图 1)。
1.2.2 分析图像
打开所有患者经食道超声心动图检查所得的三维动态图像,进行逐帧回放,导出数据后采用Qlab对左心耳相关参数进行分析计算,包括左心耳最大容积(LAAVmax)、左心耳最小容积(LAAVmin)、左心耳开口最大面积(MA)、左心耳开口最大长径(MD)、左心耳最大排空速度(LAAeV)及左心耳最大充盈速度(LAAfV)[8]。
1.3 观察指标
① 记录3组常规经胸超声心动图检查测得的LAD水平。②评估3组左心耳内有无自发显影(SEC)和血栓形成情况, SEC严重程度和血栓形成的判定标准参考相关文献[9]。③比较3组左心耳容积及功能相关参数水平。④对患者进行为期12个月的随访,记录随访期间主要终点事件和次要终点事件的发生情况。
1.4 统计学分析
采用SPSS 20.0软件分析数据,计量资料均符合正态分布,以(x±s)表示。房颤组与非房颤组组间比较采用独立样本t检验,多组间比较采用单因素方差分析,进一步两两比较采用LSD-t检验; 计数资料以[n(%)]表示,行χ2检验。检验标准α=0.05。P < 0.05为差异有统计学意义。
2. 结果
2.1 3组基线资料比较
3组患者基线资料比较,差异无统计学意义(P>0.05); 房颤组患者的LAD大于非房颤组和对照组,差异有统计学意义(P < 0.05); 非房颤组患者的LAD与对照组比较,差异无统计学意义(P>0.05), 见表 1。
表 1 3组基线资料比较(x±s)[n(%)]基线资料 房颤组(n=44) 非房颤组(n=36) 对照组(n=30) Z/F P 性别 男 26(59.09) 22(61.11) 18(60.00) 0.030 0.854 女 18(40.91) 14(38.89) 12(40.00) 年龄/岁 61.94±7.94 62.08±8.06 62.17±8.02 0.008 0.992 体质量指数/(kg/m2) 21.63±1.43 21.58±1.44 21.53±1.49 0.043 0.958 吸烟史 22(50.00) 19(52.78) 12(40.00) 1.170 0.280 饮酒史 25(56.82) 17(47.22) 13(43.33) 1.460 0.227 左房内径/mm 41.35±3.55 34.40±0.35 34.36±0.38 124.607 < 0.001 2.2 3组左心耳SEC严重程度比较
房颤组、非房颤组SEC严重患者占比高于对照组,差异有统计学意义(P < 0.05)。房颤组SEC严重程度分布情况与非房颤组相比,差异无统计学意义(P>0.05), 见表 2。
表 2 3组左心耳SEC严重程度比较[n(%)]严重程度 房颤组(n=44) 非房颤组(n=36) 对照组(n=30) Z P 无 29(65.91) 28(77.78) 30(100.00) 14.420 0.006 轻度 4(9.09) 2(5.56) 0 中度 5(11.36) 4(11.11) 0 重度 4(9.09) 2(5.56) 0 血栓形成 2(4.55) 0 0 2.3 3组左心耳容积及功能相关参数比较
与对照组相比,房颤组患者及非房颤组患者LAAVmax、LAAVmin、左心耳开口MA、左心耳开口MD均增大, LAAeV及LAAfV均减小,差异有统计学意义(P < 0.05); 房颤组患者的LAAVmax、LAAVmin、左心耳开口MA、左心耳开口MD均大于非房颤组, LAAeV及LAAfV均小于非房颤组,差异有统计学意义(P < 0.05), 见表 3。
表 3 3组左心耳容积及功能相关参数比较(x±s)参数 房颤组(n=44) 非房颤组(n=36) 对照组(n=30) F P LAAVmax/mL 7.73±2.37*# 5.46±1.54* 3.57±1.03 47.724 < 0.001 LAAVmin/mL 5.24±1.68*# 3.12±0.93* 1.73±0.52 77.672 < 0.001 左心耳开口MA/mm2 6.35±1.68*# 4.61±1.33* 2.97±0.89 53.721 < 0.001 左心耳开口MD/mm 3.91±0.59*# 3.57±0.57* 3.03±0.43 22.323 < 0.001 LAAeV/(m/s) 0.15±0.04*# 0.41±0.13* 0.72±0.14 253.230 < 0.001 LAAfV/(m/s) 0.22±0.07*# 0.51±0.15* 0.68±0.10 167.535 < 0.001 LAAVmax: 左心耳最大容积; LAAVmin: 左心耳最小容积; MA: 最大面积; MD: 最大长径; LAAeV: 左心耳最大排空速度; LAAfV: 左心耳最大充盈速度。与对照组比较, * P < 0.05; 与非房颤组比较, #P < 0.05。 2.4 SEC患者左心耳容积及功能相关参数比较
与房颤组SEC患者相比,非房颤组SEC患者的LAAVmax、LAAVmin、左心耳开口MA、左心耳开口MD较小, LAAeV及LAAfV较大,差异有统计学意义(P < 0.05), 见表 4。
表 4 房颤组与非房颤组SEC患者的左心耳容积及功能相关参数比较(x±s)参数 房颤组(n=15) 非房颤组(n=8) LAAVmax/mL 7.86±1.82* 6.05±1.03 LAAVmin/mL 5.52±1.71* 3.53±0.52 左心耳开口MA/mm2 6.64±1.83* 4.47±0.89 左心耳开口MD/mm 4.16±0.75* 3.71±0.43 LAAeV/(m/s) 0.13±0.03* 0.29±0.14 LAAfV/(m/s) 0.20±0.06* 0.47±0.10 与非房颤组比较, * P < 0.05。 2.5 预后情况
房颤组与非房颤组经卵圆孔未闭封堵术的手术成功率均为100.00%。治疗后,房颤组总终点事件发生率高于非房颤组,差异有统计学意义(P < 0.05), 见表 5。
表 5 房颤组与非房颤组预后情况比较[n(%)]预后 分类 房颤组(n=44) 非房颤组(n=36) 主要终点事件 卒中 3(6.82) 1(2.78) 死亡 1(2.27) 0 血管栓塞 1(2.27) 0 次要终点事件 新发房颤 4(9.09) 2(5.56) 心肌梗死 1(2.27) 1(2.78) 再次住院 2(4.55) 0 出血 3(6.82) 1(2.78) 总终点事件 15(34.09)* 5(13.89) 与非房颤组比较, * P < 0.05。 3. 讨论
卵圆孔是胎儿在胚胎发育时期心脏的一个重要结构,正常情况下,其在出生后会自动闭合,但研究[10]发现, 20%~25%的成年人卵圆孔不完全闭合。房颤是一种心脏发生不规则快速小幅颤动的表现,其是心脏内血栓形成和脑卒中发生的主要原因,与常规窦性心律患者相比,房颤患者发生缺血性脑卒中的风险更高[11-12]。
左心耳是左心房右前方向突出的部分,主要用于容纳、缓冲和调节心房内血液流动。左心耳内存在凹凸不平的肌小梁,容易使得血流产生旋涡和流速减慢,因此其也是左心房内血栓的好发部位。相关文献[13-14]报道,房颤导致中风的血栓, 90%以上源于左心耳。左心耳大部分被左心房遮挡,常规的经胸心脏超声心动图虽可以较好显示左心房结构,但对于左心耳容积和结构的改变不是很敏感[15]。左心耳与食管近邻,可通过将超声探头放置于食道内观察,进行经食道心脏超声检查。
本研究结果显示,房颤组患者的LAD较非房颤组患者及对照组显著增大,而非房颤组患者与对照组比较无显著差异。分析原因为,当房颤发生时,血液处于瘀滞状态,导致左心房内压力升高,左心耳通过增加内径来缓解压力,以保证左心室血量充盈。相关研究[16]表示,并非所有的卵圆孔未闭均会导致LAD增大,但当患者出现LAD增大时,预示着其合并房颤的风险增加。本研究结果显示,房颤组患者及非房颤组患者SEC程度较为严重,且检查出房颤组出现2例血栓形成患者。当卵圆孔未闭时,左心耳因具有正常收缩功能,极少形成血栓,但患者左心房内的收缩功能降低,血流排空速度下降,进而出现自发性显影。当合并房颤时,左心房及左心耳均会失去正常的收缩功能,加之左心耳表面结构特殊,血流速度减缓,导致血液瘀滞,从而形成血栓[17]。而本研究中房颤组与非房颤组的SEC严重程度无显著差异,可能与本研究纳入样本量较小有关。本研究对3组左心耳开口MD、MA及左心耳容积相关参数进行检查分析,结果提示,卵圆孔未闭合并房颤会使左心耳开口MA及容积增大,降低左心耳排空功能,这与陈静婉等[18]研究结果一致。卵圆孔未闭会导致左心房内压力增大,为了保证左心室血液充盈,左心房及左心耳内径也会随之增大,加强收缩功能,缓解左心室压力,进而充盈及排空速度降低。合并房颤时,左心耳开口会显著增宽,形状结构会发生改变,左心耳容积也随之增大。但此时左心耳已失去正常收缩功能,左心壁的内向运动难以足够排空左心耳,因此其充盈及排空速度逐渐降低。此外本研究中,房颤组患者和非房颤组经卵圆孔未闭封堵术的手术成功率均为100.00%, 房颤组总终点事件发生率显著高于非房颤组。由此提示,经食道超声心动图检查对卵圆孔未闭合并房颤患者具有良好的诊断价值,能够评估患者预后情况。
综上所述,对卵圆孔未闭合并房颤患者行食道超声心动图检查可清晰观察其左心耳生理结构,可更加准确地评估左心耳容积及功能改变。
-
表 1 各组大鼠灌胃给药持续时间对体质量变化的影响(x±s)
g 组别 n 0 d 2 d 4 d 6 d 8 d 10 d 12 d 14 d 正常组 10 190.1±10.2 193.1±9.2 197.3±10.9 201.4±12.5 203.9±7.4 209.7±8.9 214.2±14.2 221.1±12.7 模型组 10 195.7±12.7 197.1±7.2 199.5±12.6 204.7±11.5 212.4±9.8 215.5±9.6 220.0±13.7 227.8±9.2 治疗组 10 200.5±9.6 201.0±10.2 206.9±14.1 208.4±10.5 210.9±9.3 217.4±13.5 219.6±13.4 225.4±14.1 表 2 各组大鼠ERG检测(x±s)
μV 组别 n 暗适应0.01 ERG 暗适应3.0 ERG 暗适应3.0震荡电位 明适应3.0 ERG 明适应3.0闪烁光反应 正常组 10 312.55±32.12 351.80±40.12 240.99±20.20 361.09±40.12 191.50±16.12 模型组 10 113.56±28.21* 233.56±10.21* 124.05±40.06* 253.56±36.21* 113.56±20.21* 治疗组 10 240.49±30.08# 298.49±30.08# 230.12±35.03# 300.49±20.08# 182.49±10.08# 与正常组比较, * P<0.05; 与模型组比较, #P<0.05。 表 3 各组大鼠视网膜外核层细胞数和视网膜色素上皮层数变化(x±s)
组别 n 视网膜外核层细胞数/(个/视野) 视网膜色素上皮层数/(层/视野) 正常组 10 186.90±12.50 6.17±2.01 模型组 10 72.90±15.60** 1.56±0.93** 治疗组 10 126.40±13.60## 3.49±0.88# 与正常组比较, * * P<0.01; 与模型组比较, #P<0.05, ##P<0.01。 表 4 各组大鼠眼球巨噬细胞CD36、CD206阳性细胞比率变化(x±s)
组别 n CD36/% CD206/% 正常组 10 55.63±8.73 21.63±7.81 模型组 10 33.98±6.86* 43.59±6.51** 治疗组 10 46.86±3.83## 31.52±4.08## 与正常组比较, * P<0.05, * * P<0.01;
与模型组比较, ##P<0.01。 -
[1] 熊金巧, 彭惠. TLR3与年龄相关性黄斑变性疾病的相关性[J]. 国际眼科杂志, 2014, 14(3): 454-456. https://www.cnki.com.cn/Article/CJFDTOTAL-GJYK201403022.htm [2] DING X Y, PATEL M, CHAN C C. Molecular pathology of age-related macular degeneration[J]. Prog Retin Eye Res, 2009, 28(1): 1-18. doi: 10.1016/j.preteyeres.2008.10.001
[3] 刘庆淮, 袁冬青. 年龄相关性黄斑变性发病机制新进展[J]. 实用老年医学, 2014, 28(10): 796-800. doi: 10.3969/j.issn.1003-9198.2014.10.002 [4] 刘原, 张敏, 黄滔敏, 等. 年龄相关性黄斑变性眼用新制剂的研究进展[J]. 中国眼耳鼻喉科杂志, 2019, 19(3): 202-206. https://www.cnki.com.cn/Article/CJFDTOTAL-YRBH201903027.htm [5] 刘芳, 李加青. 巨噬细胞极化与AMD的关系[J]. 中华实验眼科杂志, 2016, 34(1): 89-91. doi: 10.3760/cma.j.issn.2095-0160.2016.01.019 [6] SOMASUNDARAN S, CONSTABLE I J, MELLOUGH C B, et al. Retinal pigment epithelium and age-related macular degeneration: a review of major disease mechanisms[J]. Clin Exp Ophthalmol, 2020, 48(8): 1043-1056. doi: 10.1111/ceo.13834
[7] 杜茂波, 刘淑芝, 许凯, 等. 治疗老年黄斑变性病的药物制剂概述[J]. 中国中药杂志, 2017, 42(4): 628-633. https://www.cnki.com.cn/Article/CJFDTOTAL-ZGZY201704003.htm [8] 孙子雯, 汤垟, 陈晨, 等. 年龄相关性黄斑变性的发病机制与抗氧化治疗[J]. 国际眼科杂志, 2020, 20(3): 468-471. https://www.cnki.com.cn/Article/CJFDTOTAL-GJYK202003015.htm [9] 许凯. 黄芪甲苷纳米乳眼用凝胶对实验性大鼠干性年龄相关性黄斑变性的作用研究[D]. 北京: 中国中医科学院, 2018. [10] 赵永吉, 丁秋爱, 游志鹏. 老年性黄斑变性免疫炎症机制的研究进展[J]. 眼科新进展, 2017, 37(11): 1079-1082. https://www.cnki.com.cn/Article/CJFDTOTAL-XKJZ201711022.htm [11] HORANI M, MAHMOOD S, ASLAM T M. Macular atrophy of the retinal pigment epithelium in patients with neovascular age-related macular degeneration: what is the link? part Ⅰ: a review of disease characterization and morphological associations[J]. Ophthalmol Ther, 2019, 8(2): 235-249. doi: 10.1007/s40123-019-0177-7
[12] 马映雪, 陈松. 免疫活化和调节异常在老年性黄斑变性发病中的作用研究进展[J]. 中华眼底病杂志, 2016, 32(1): 100-103. doi: 10.3760/cma.j.issn.1005-1015.2016.01.028 [13] 张子明, 柴国静, 宋淑霞. 肿瘤相关巨噬细胞的极化及其对肿瘤治疗的影响[J]. 中国免疫学杂志, 2019, 35(8): 1018-1023. doi: 10.3969/j.issn.1000-484X.2019.08.026 [14] VANNELLA K M, WYNN T A. Mechanisms of organ injury and repair by macrophages[J]. Annu Rev Physiol, 2017, 79: 593-617. doi: 10.1146/annurev-physiol-022516-034356
[15] MARTINEZ F O, GORDON S. The M1 and M2 paradigm of macrophage activation: time for reassessment[J]. F1000Prime Rep, 2014, 6: 13.
[16] 雷蕾, 丁小燕, 唐仕波. 巨噬细胞与小胶质细胞在老年性黄斑变性发病机制中的调控作用[J]. 中华眼底病杂志, 2010, 26(6): 588-591. doi: 10.3760/cma.j.issn.1005-1015.2010.06.33 [17] 王诗惠. 年龄相关性黄斑变性玻璃膜疣患者中医体质类型研究[D]. 北京: 中国中医科学院, 2019. [18] FORRESTER J V. Macrophages eyed in macular degeneration[J]. Nat Med, 2003, 9(11): 1350-1351. doi: 10.1038/nm1103-1350
[19] PEREZ V L, CASPI R R. Immune mechanisms in inflammatory and degenerative eye disease[J]. Trends Immunol, 2015, 36(6): 354-363. doi: 10.1016/j.it.2015.04.003
[20] DING X Y, PATEL M, CHAN C C. Molecular pathology of age-related macular degeneration[J]. Prog Retin Eye Res, 2009, 28(1): 1-18. doi: 10.1016/j.preteyeres.2008.10.001
[21] DOYLE S L, LÓPEZ F J, CELKOVA L, et al. IL-18 immunotherapy for neovascular AMD: tolerability and efficacy in nonhuman Primates[J]. Invest Ophthalmol Vis Sci, 2015, 56(9): 5424-5430. doi: 10.1167/iovs.15-17264
[22] EVANS J R, LAWRENSON J G. Antioxidant vitamin and mineral supplements for slowing the progression of age-related macular degeneration[J]. Cochrane Database Syst Rev, 2017, 7(7): CD000254.
[23] OKREGLICKA K, SKWIERCZYNSKA Z, WISNIEWSKA K, et al. The effect of selected vitamins, minarals and antioxidants on age-related macular degeneration[J]. Pol Merkur Lekarski, 2019, 47(277): 35-39.
[24] CHEW E Y, CLEMONS T E, AGRÓN E, et al. Long-term effects of vitamins C and E, β-carotene, and zinc on age-related macular degeneration: AREDS report no. 35[J]. Ophthalmology, 2013, 120(8): 1604-1611, e4. doi: 10.1016/j.ophtha.2013.01.021
[25] 孙秀川. 维生素C对机体免疫功能的影响[J]. 内蒙古医学杂志, 2014, 46(2): 174-176. https://www.cnki.com.cn/Article/CJFDTOTAL-NMYZ201402016.htm [26] 范志浩, 李媛媛, 李莉霞, 等. 维生素C对巨噬细胞增殖、迁移及吞噬功能的影响[J]. 中国临床解剖学杂志, 2017, 35(3): 266-270. https://www.cnki.com.cn/Article/CJFDTOTAL-ZLJZ201703008.htm [27] 谢嘉华, 陈朝阳, 伍兴国. 维生素C对金鲫头肾和脾脏免疫细胞的影响[J]. 泉州师范学院学报, 2009, 27(6): 89-93. https://www.cnki.com.cn/Article/CJFDTOTAL-QZXB200906023.htm





 下载:
下载:
 苏公网安备 32100302010246号
苏公网安备 32100302010246号
