Changes of sex hormones after ovarian function suppression in patients with breast cancer
-
摘要:目的
回顾性分析不同年龄激素受体(HR)阳性早期乳腺癌患者在绝经前接受卵巢功能抑制(OFS)后的性激素变化及预后。
方法将使用戈舍瑞林治疗的乳腺癌患者144例分为≤40岁组(n=61)和>40岁组(n=83)。比较2组患者的临床病理资料、血清性激素水平、生存事件、月经恢复情况及药物不良反应发生情况。
结果2组患者体质量指数比较, 差异有统计学意义(P=0.003)。2组患者雌二醇(E2)、促卵泡生成素(FSH)比较,差异有统计学意义(P < 0.05或P < 0.01), 而黄体生成素(LH)的差异无统计学意义(P>0.05)。2组患者无病生存期(DFS)、月经恢复情况比较,差异无统计学意义(P>0.05)。2组乏力、恶心发生率比较,差异有统计学意义(P=0.011、0.010)。
结论在绝经前HR阳性乳腺癌患者中,年龄通过影响E2及FSH的变化而影响OFS的效果,而OFS的激素变化与预后的关系还需要进一步研究。
Abstract:ObjectiveTo retrospectively analyze the changes of sex hormones and prognosis in early-stage breast cancer patients positive for hormone receptor (HR) at different ages after ovarian function suppression (OFS) before menopause.
MethodsA total of 144 breast cancer patients treated with goserelin were divided into ≤40 year old group (n=61) and >40 year old group (n=83). The clinicopathological materials, serum levels of sex hormones, survival events, menstrual recovery and incidence of adverse reactions of drugs were compared between the two groups.
ResultsThere was a significant difference in body mass index between the two groups (P=0.003). There were significant differences in estradiol (E2) and follicle stimulating hormone (FSH) between the two groups (P < 0.05 or P < 0.01), but no significant difference was found in luteinizing hormone (LH) (P>0.05). There were no significant differences in disease-free survival (DFS) and menstrual recovery between the two groups (P>0.05). There were significant differences in the incidence rates of fatigue and nausea between the two groups (P=0.011, 0.010).
ConclusionIn breast cancer patients positive for HR before menopause, age can affect the efficacy of OFS by affecting the changes of E2 and FSH, and the relationship of the hormonal changes of OFS with prognosis needs to be further studied.
-
Keywords:
- menopause /
- hormonal receptor /
- breast cancer /
- ovarian function suppression /
- sex hormones /
- disease-free survival
-
乳腺癌已经成为全球高发的癌症类型,中国女性乳腺癌发病率为9.1%, 病死率为3.9%[1-2]。超过50%中国女性确诊乳腺癌时处于绝经前状态[3], 其中激素受体(HR)阳性类型占所有乳腺癌类型的80%左右[4-5]。内分泌治疗是绝经前HR阳性乳腺癌的重要治疗方案,近年来基于卵巢功能抑制(OFS)的辅助内分泌治疗在生存获益方面逐步获得肯定[6], 药物去势更是作为首选治疗策略[7]。然而,OFS不完全的情况时有发生[8-9]。有研究[10]通过监测血清雌二醇(E2)水平来确定46例绝经前HR阳性乳腺癌患者使用药物去势进行OFS的情况,结果发现在初始3个月、第12个月分别有24.0%、6.5%个体发生卵巢抑制不完全,进一步研究发现年龄是有统计学意义的变量(P=0.024)。本研究比较不同年龄组乳腺癌患者OFS后性激素变化差异及预后情况,探讨激素变化与预后的关系,记录药物治疗的不良反应以及月经情况,现将结果报告如下。
1. 资料与方法
1.1 一般资料
收集2012年12月—2019年7月在南京医科大学附属常州第二人民医院使用戈舍瑞林(英国阿斯利康公司)进行OFS的144例乳腺癌患者的临床病理资料。纳入标准: 经术后病理证实为乳腺癌者[11]; 雌激素受体(ER)和(或)孕激素受体(PR)≥10%者; 进行OFS前处于绝经前状态(有完整月经周期)者; 无严重的全身性疾病者。排除标准: 男性乳腺癌患者; 合并其他部位恶性肿瘤者; 既往接受过内分泌治疗者; 接受过双侧卵巢切除手术者。
1.2 资料收集
通过查阅病历收集患者的临床病理信息,包括年龄、手术方式、肿瘤大小、淋巴结状态、体质量指数、化疗周期及方案、术后病理和(或)穿刺病理[组织学分级、病理类型、ER、PR、人表皮生长因子受体-2(HER-2)、细胞增殖核抗原(Ki-67)]、基础及治疗期间血清性激素3项[E2、促卵泡生成素(FSH)、黄体生成素(LH)]检测结果以及资料收集截止日患者生存事件(包括局部复发、对侧乳腺癌、远处复发、第2次恶性肿瘤)。HER-2阳性定义为免疫组化检测为(


1.3 观察指标
将144例患者分为2组,即≤40岁组和>40岁组,比较2组临床病理资料的差异。将患者的血清性激素3项(E2、FSH、LH)检测结果按照时点(基础以及治疗后第1、2、3、6、12、18、24、36、48、60个月)收集后进行比较,进行差异性分析。根据收集的数据资料计算2组患者的无病生存期(DFS)。比较2组患者月经恢复情况以及不良反应发生情况。
1.4 统计学分析
采用SPSS 25.0软件进行数据处理。计数资料采用[n(%)]表示,组间比较采用卡方检验或Fisher确切概率检验。计量资料不符合正态分布的采用中位数(四分位间距)[M(P25, P75)]表示,组间比较采用秩和检验。针对生存事件进行生存分析,采用Kaplan-Meier分析法。P < 0.05为差异有统计学意义。
2. 结果
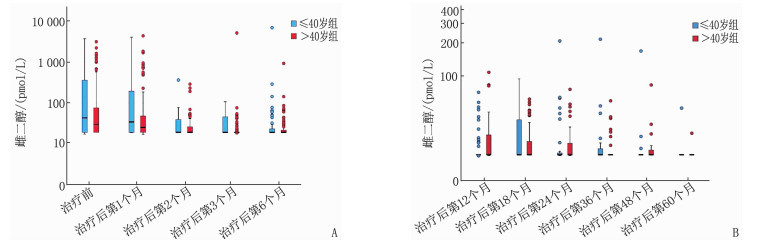
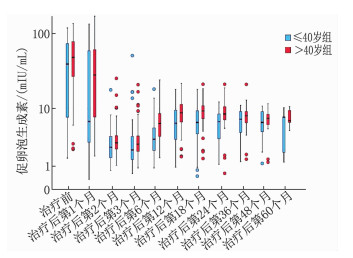
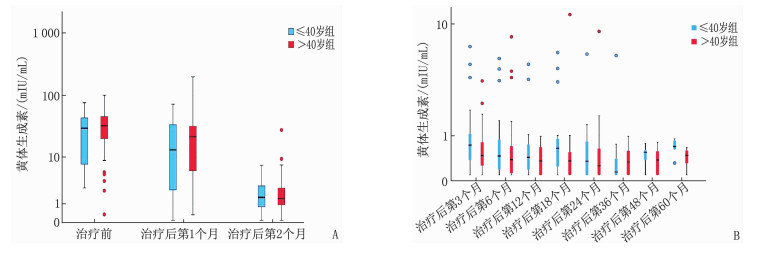
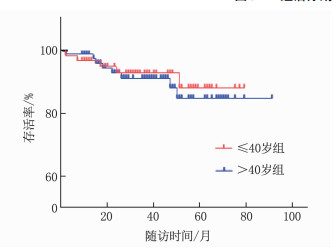
≤40岁组共61例,中位年龄36岁; >40岁组共83例,中位年龄47岁。2组在ER、PR、HER-2、Ki-67、肿瘤分期、淋巴结状态、手术方式、化疗周期及病理分级方面比较,差异均无统计学意义(P>0.05), 见表 1。2组体质量指数(BMI)、E2、FSH比较,差异有统计学意义(P < 0.05或P < 0.01), 见表 2及图 1、2、3。在生存方面, 2组共有13例生存事件发生, ≤40岁组含5例(中位随访时间34个月),包括2例骨转移、1例肺转移、1例淋巴结转移、1例卵巢转移; >40岁组含8例(中位随访时间36个月),包括2例骨转移、2例肝转移、3例肺癌、1例胆囊癌。2组患者生存情况比较,差异无统计学意义(P=0.726), 见图 4。
表 1 ≤40岁组与>40岁组患者临床病理特征比较[n(%)]临床病理特征 分类 ≤40岁组(n=61) >40岁组(n=83) χ2 P ER状态* 阳性 59(96.72) 81(97.59) — 1.000 阴性 2(3.28) 2(2.41) PR状态 阳性 51(83.61) 75(90.36) 1.467 0.226 阴性 10(16.39) 8(9.64) HER-2 阳性 21(34.43) 18(21.69) 2.889 0.089 阴性 40(65.57) 65(78.31) Ki-67 ≤20% 34(55.74) 53(63.86) 0.969 0.325 >20% 27(44.26) 30(36.14) 肿瘤分期* 未知 5(8.20) 6(7.23) — 0.133 1期 36(59.02) 42(50.60) 2期 16(26.23) 34(40.96) 3期 4(6.55) 1(1.21) 淋巴结病理分期* 0期 36(59.02) 44(53.01) — 0.114 1期 14(22.95) 23(27.71) 2期 11(18.03) 10(12.05) 3期 0 6(7.23) 病理分级* 未知 13(21.31) 14(16.87) — 0.205 1级 6(9.84) 3(3.61) 2~3级 42(68.85) 66(79.52) 化疗周期* 未化疗 3(4.92) 7(8.44) — 0.149 ≤6个周期 24(39.34) 42(50.60) 7~8个周期 34(55.74) 32(38.55) ≥9个周期 0 2(2.41) 手术方式 改良根治术 36(59.02) 55(66.27) 1.632 0.346 单纯切除术 13(21.31) 18(21.68) 保乳术 12(19.67) 10(12.05) ER: 雌激素受体; PR: 孕激素受体; HER-2: 人表皮生长因子受体-2; Ki-67: 细胞增殖核抗原。
*表示不符合卡方检验,使用Fisher确切概率检验。表 2 ≤40岁组与>40岁组患者体质量指数及性激素比较[M(P25, P75)]指标 ≤40岁组(n=61) >40岁组(n=83) 体质量指数/(kg/m2) 21.72(20.08, 24.17) 23.24(21.56, 26.31)** 雌二醇/(pmol/L) 18.35(18.35, 44.62) 18.35(18.35, 28.97)* 促卵泡生成素/(mIU/mL) 4.88(2.25, 9.34) 7.40(3.48, 13.12)** 黄体生成素/(mIU/mL) 0.81(0.34, 3.74) 0.70(0.30, 3.58) 与≤40岁组比较,*P<0.05,**P<0.01。 截至2021年11月, ≤40岁组有4例恢复月经,分别在结束治疗后6、6、6、10个月; >40岁组有1例恢复月经,在结束治疗后24个月; 2组患者月经恢复情况比较,差异无统计学意义(P=0.163)。本研究出现的不良反应主要有潮热、抑郁、出汗、失眠、乏力、阴道干涩、性欲下降、性生活困难、恶心、骨骼肌肉症状、骨质疏松、高血压、注射部位痛、过敏反应及头痛,2组乏力、恶心发生率比较,差异有统计学意义(P=0.011、0.010)。本研究出现的3~4级不良反应主要是失眠、骨骼肌肉症状、骨质疏松、高血压、注射部位疼痛及过敏反应,其中≤40岁组3~4级不良反应为骨质疏松2例、高血压2例, >40岁组3~4级不良反应为失眠3例、骨骼肌肉症状3例、骨质疏松2例、注射部位疼痛1例及过敏反应2例,且有1例因注射部位疼痛停止注射戈舍瑞林。2组3~4级不良反应方面比较,差异无统计学意义(P=0.272), 见表 3。
表 3 2组患者不良反应情况比较[n(%)]不良反应 ≤40岁组(n=61) >40岁组(n=83) χ2 P 潮热 25(40.98) 44(53.01) 2.038 0.179 抑郁 7(11.48) 18(21.68) 2.555 0.124 出汗 25(40.98) 44(53.01) 2.038 0.179 失眠 24(39.34) 27(32.53) 0.714 0.252 乏力 20(32.79) 46(55.42) 7.256 0.011 阴道干涩 40(65.57) 28(33.73) 0.154 0.730 性欲下降 40(65.57) 28(33.73) 0.154 0.730 性生活困难 40(65.57) 28(33.73) 0.154 0.730 恶心* 0 9(10.84) — 0.010 骨骼肌肉症状 33(54.10) 49(59.04) 0.350 0.611 骨质疏松 18(29.51) 25(30.12) 0.006 1.000 高血压 8(13.11) 9(10.84) 0.174 0.795 注射部位痛 10(16.39) 15(18.07) 0.069 0.828 过敏反应 10(16.39) 12(14.46) 0.102 0.817 头痛* 1(1.64) 1(1.20) — 1.000 任何3~4级不良反应 4(6.56) 11(13.25) 1.689 0.272 *表示不符合卡方检验,使用Fisher确切概率检验。 3. 讨论
卵巢功能抑制试验(SOFT)更新的8年随访研究[6]揭示了联合OFS治疗的生存获益,指南[7]推荐中高风险的绝经前HR阳性乳腺癌患者应接受OFS治疗。然而, OFS不完全的现象时有发生[8, 14], 在SOFT雌激素亚研究(SOFT-EST)[9]中,接受曲普瑞林联合依西美坦治疗的86例患者中,在3、6、12个月时分别有25%、24%、17%病例出现E2>2.72 pg/mL的情况。BURNS E等[10]进一步研究OFS不完全的情况,共招募46例乳腺癌患者,通过监测治疗期间E2的数值来确定OFS情况; 在治疗的最初3个月,有11例患者出现了OFS不完全现象; 对上述患者继续跟踪监测,在第6个月,有4例患者继续发生OFS不完全; 在第12个月,仍然有3例患者从未在E2水平上达到理想的OFS; 统计分析指出年龄是有意义的影响因素(P=0.024), 而出现卵巢逃逸和达到OFS的平均年龄分别为38.5岁和43.0岁。
本研究初步拟定以40岁为年龄界限,探索≤40岁组和>40岁组绝经前HR阳性早期乳腺癌患者OFS治疗过程中性激素变化的差异,结果显示, 2组E2、FSH存在显著差异(P < 0.05或P < 0.01), 其中≤40岁组有更高的E2和更低的FSH水平,与SOFT-EST的结果一致。虽然q40岁者有更好的卵巢储备能力[15-17], 但也更有可能发生OFS不全的情况,这一非预期的治疗效果对月经状况的评估会造成困扰,影响后续内分泌治疗药物的使用。本研究中,截至2021年11月, ≤40岁组有4例在结束治疗后6、6、6、10个月恢复月经, >40岁组有1例在结束治疗后24个月恢复月经,但2组差异无统计学意义(P=0.163)。这与以往ASTRRA试验[18]及PROMISE-GIM6试验[19]报道的月经恢复情况不同。ASTRRA试验共纳入1 370例进行化疗后仍然处于绝经前状态的HR阳性乳腺癌患者,将受试者按照1∶1接受他莫昔芬5年治疗或者他莫昔芬5年联合OFS的2年治疗,经过2年随访发现月经恢复率达到93.6%。PROMISE-GIM6试验接受化疗联合OFS 2年治疗的148例HR阳性乳腺癌患者,在5年随访过程中月经恢复率为69.3%。本研究与上述2项研究存在差异的原因可能是: ①纳入标准未限制年龄≤45岁,仅需绝经前状态即可; ②进行OFS治疗持续时间不同; ③ ASTRRA试验排除了特定化疗方案,本研究未排除任何化疗方案; ④本研究对象为HR阳性早期乳腺癌患者,预后较好,而影响DFS的事件发生的因素需要更长的随访时间来确定[20-21]。
KLASSEN O等[22]研究表明,接受放化疗的乳腺癌患者有较高的肌肉疲劳率,其原因可能与不同年龄患者体质差异有关,年龄大的患者身体耐受力较差。不良反应的研究采用调查问卷形式,存在回忆偏倚, OFS引起的不良反应会有时间效应,会导致一定偏倚[23]。ZHANG W等[24]研究显示,女性乳腺癌患者的BMI在不同年龄之间存在差异。研究[25]显示BMI与血清FSH、LH代谢相关。本研究中2组FSH存在差异,与之相关的BMI也有可能存在差异。化疗对体质量有一定影响,本研究部分患者在获取BMI数据前进行了新辅助化疗,所以新辅助化疗或许也是影响组间BMI差异的因素[26]。
本研究的局限性是纳入样本量较少、随访时间较短,作为回顾性分析,不能即时随访,存在误差; 优点是拥有患者较长治疗期间的连续激素变化资料,可较全面地比较OFS的相关预后,包括月经恢复情况、不良反应以及生存事件发生情况。总之,在绝经前HR阳性乳腺癌患者中,年龄通过影响E2及FSH的变化而影响OFS的效果,而OFS的激素变化与预后的关系还需要进一步研究。
-
表 1 ≤40岁组与>40岁组患者临床病理特征比较[n(%)]
临床病理特征 分类 ≤40岁组(n=61) >40岁组(n=83) χ2 P ER状态* 阳性 59(96.72) 81(97.59) — 1.000 阴性 2(3.28) 2(2.41) PR状态 阳性 51(83.61) 75(90.36) 1.467 0.226 阴性 10(16.39) 8(9.64) HER-2 阳性 21(34.43) 18(21.69) 2.889 0.089 阴性 40(65.57) 65(78.31) Ki-67 ≤20% 34(55.74) 53(63.86) 0.969 0.325 >20% 27(44.26) 30(36.14) 肿瘤分期* 未知 5(8.20) 6(7.23) — 0.133 1期 36(59.02) 42(50.60) 2期 16(26.23) 34(40.96) 3期 4(6.55) 1(1.21) 淋巴结病理分期* 0期 36(59.02) 44(53.01) — 0.114 1期 14(22.95) 23(27.71) 2期 11(18.03) 10(12.05) 3期 0 6(7.23) 病理分级* 未知 13(21.31) 14(16.87) — 0.205 1级 6(9.84) 3(3.61) 2~3级 42(68.85) 66(79.52) 化疗周期* 未化疗 3(4.92) 7(8.44) — 0.149 ≤6个周期 24(39.34) 42(50.60) 7~8个周期 34(55.74) 32(38.55) ≥9个周期 0 2(2.41) 手术方式 改良根治术 36(59.02) 55(66.27) 1.632 0.346 单纯切除术 13(21.31) 18(21.68) 保乳术 12(19.67) 10(12.05) ER: 雌激素受体; PR: 孕激素受体; HER-2: 人表皮生长因子受体-2; Ki-67: 细胞增殖核抗原。
*表示不符合卡方检验,使用Fisher确切概率检验。表 2 ≤40岁组与>40岁组患者体质量指数及性激素比较[M(P25, P75)]
指标 ≤40岁组(n=61) >40岁组(n=83) 体质量指数/(kg/m2) 21.72(20.08, 24.17) 23.24(21.56, 26.31)** 雌二醇/(pmol/L) 18.35(18.35, 44.62) 18.35(18.35, 28.97)* 促卵泡生成素/(mIU/mL) 4.88(2.25, 9.34) 7.40(3.48, 13.12)** 黄体生成素/(mIU/mL) 0.81(0.34, 3.74) 0.70(0.30, 3.58) 与≤40岁组比较,*P<0.05,**P<0.01。 表 3 2组患者不良反应情况比较[n(%)]
不良反应 ≤40岁组(n=61) >40岁组(n=83) χ2 P 潮热 25(40.98) 44(53.01) 2.038 0.179 抑郁 7(11.48) 18(21.68) 2.555 0.124 出汗 25(40.98) 44(53.01) 2.038 0.179 失眠 24(39.34) 27(32.53) 0.714 0.252 乏力 20(32.79) 46(55.42) 7.256 0.011 阴道干涩 40(65.57) 28(33.73) 0.154 0.730 性欲下降 40(65.57) 28(33.73) 0.154 0.730 性生活困难 40(65.57) 28(33.73) 0.154 0.730 恶心* 0 9(10.84) — 0.010 骨骼肌肉症状 33(54.10) 49(59.04) 0.350 0.611 骨质疏松 18(29.51) 25(30.12) 0.006 1.000 高血压 8(13.11) 9(10.84) 0.174 0.795 注射部位痛 10(16.39) 15(18.07) 0.069 0.828 过敏反应 10(16.39) 12(14.46) 0.102 0.817 头痛* 1(1.64) 1(1.20) — 1.000 任何3~4级不良反应 4(6.56) 11(13.25) 1.689 0.272 *表示不符合卡方检验,使用Fisher确切概率检验。 -
[1] SUNG H, FERLAY J, SIEGELR L, et al. Global cancer statistics 2020: GLOBOCAN estimates of incidence and mortality worldwide for 36 cancers in 185 countries[J]. CA Cancer J Clin, 2021, 71(3): 209-249. doi: 10.3322/caac.21660
[2] 张雅聪, 吕章艳, 宋方方, 等. 全球及我国乳腺癌发病和死亡变化趋势[J]. 肿瘤综合治疗电子杂志, 2021, 7(2): 14-20. https://www.cnki.com.cn/Article/CJFDTOTAL-ZLZD202102002.htm [3] WANG K, WUY T, ZHANG X, et al. Clinicopathologic and prognostic significance of body mass index (BMI) among breast cancer patients in Western China: aretrospective multicenter cohort based on Western China clinical cooperation group (WCCCG)[J]. Biomed Res Int, 2019: 3692093.
[4] HARVEYJ M, CLARKG M, OSBORNEC K, et al. Estrogen receptor status by immunohistochemistry is superior to the ligand-binding assay for predicting response to adjuvant endocrine therapy in breast cancer[J]. J Clin Oncol, 1999, 17(5): 1474-1481. doi: 10.1200/JCO.1999.17.5.1474
[5] HOWLADER N, ALTEKRUSESF, LICI, et al. US incidence of breast cancer subtypes defined by joint hormone receptor and HER2 status[J]. J Natl Cancer Inst, 2014, 106(5): dju055.
[6] FRANCISP A, PAGANI O, FLEMINGG F, et al. Tailoring adjuvant endocrine therapy for premenopausal breast cancer[J]. N Engl J Med, 2018, 379(2): 122-137. doi: 10.1056/NEJMoa1803164
[7] 中国抗癌协会乳腺癌专业委员会, 胡夕春. 中国早期乳腺癌卵巢功能抑制临床应用专家共识(2018年版)[J]. 中国癌症杂志, 2018, 28(11): 871-880. https://www.cnki.com.cn/Article/CJFDTOTAL-ZGAZ201811015.htm [8] DE CIANTIS M, FAURE C, HEUDELP E, et al. Ovarian suppression failure during GnRH agonist treatment: a report of three breast cancer patients[J]. J Gynecol Obstet Hum Reprod, 2018, 47(6): 261-264. doi: 10.1016/j.jogoh.2018.03.002
[9] BELLET M, GRAYK P, FRANCISP A, et al. Twelve-month estrogen levels in premenopausal women with hormone receptor-positive breast cancer receiving adjuvant triptorelin plus exemestane or tamoxifen in the suppression of ovarian function trial (SOFT): the SOFT-EST substudy[J]. J Clin Oncol, 2016, 34(14): 1584-1593. doi: 10.1200/JCO.2015.61.2259
[10] BURNS E, KOCA E, XU J Q, et al. Measuring ovarian escape in premenopausal estrogen receptor-positive breast cancer patients on ovarian suppression therapy[J]. Oncologist, 2021, 26(6): e936-e942. doi: 10.1002/onco.13722
[11] 中国研究型医院学会乳腺专业委员会中国女性乳腺癌筛查指南制定专家组. 中国女性乳腺癌筛查指南(2022年版)[J]. 中国研究型医院, 2022, 9(2): 6-13. https://www.cnki.com.cn/Article/CJFDTOTAL-YJXU202202003.htm [12] 乳腺癌HER检测指南(版)》编写组. 乳腺癌HER2检测指南(2019版)[J]. 中华病理学杂志, 2019, 48(3): 169-175. [13] National Cancer Institute. Common Terminology Criteria for Adverse Events (CTCAE) Version 5[EB/OL]. (2020-09-01)[2022-01-11]. https://ctep. cancer. gov/protocolDevelopment/electronic_applications/docs/CTCAE_v6_Solicitation_Brief_Overview. pdf.
[14] COYNE K, SILVERMAN P, LIUJ H. Oral GnRH antagonist ovarian suppression after escape from GnRH agonist in breast cancer patients[J]. Clin Breast Cancer, 2020, 20(5): e551-e554. doi: 10.1016/j.clbc.2020.05.011
[15] KIMH A, CHOI J, PARKC S, et al. Post-chemotherapy serum anti-Müllerian hormone level predicts ovarian function recovery[J]. Endocr Connect, 2018, 7(8): 949-956. doi: 10.1530/EC-18-0180
[16] XUE C, WEI W W, SUN P, et al. Pretreatment anti-Mullerian hormone-based nomogram predicts menstruation status after chemotherapy for premenopausal women with hormone receptor-positive early breast cancer[J]. Breast Cancer Res Treat, 2019, 173(3): 619-628. doi: 10.1007/s10549-018-4997-2
[17] ANDERSONR A, MANSI J, COLEMANR E, et al. The utility of anti-Müllerian hormone in the diagnosis and prediction of loss of ovarian function following chemotherapy for early breast cancer[J]. Eur J Cancer, 2017, 87: 58-64. doi: 10.1016/j.ejca.2017.10.001
[18] KIMH A, LEEJ W, NAMS J, et al. Adding ovarian suppression to tamoxifen for premenopausal breast cancer: arandomized phase Ⅲ trial[J]. J Clin Oncol, 2020, 38(5): 434-443. doi: 10.1200/JCO.19.00126
[19] LAMBERTINI M, BONI L C, MICHELOTTI A, et al. Ovarian suppression with triptorelin during adjuvant breast cancer chemotherapy and long-term ovarian function, pregnancies, and disease-free survival: arandomized clinical trial[J]. JAMA, 2015, 314(24): 2632-2640. doi: 10.1001/jama.2015.17291
[20] SIMONS D, BINES J, WERUTSKY G, et al. Characteristics and prognosis of stage Ι-ΙΙΙ breast cancer subtypes in Brazil: the AMAZONA retrospective cohort study[J]. Breast, 2019, 44: 113-119. doi: 10.1016/j.breast.2019.01.008
[21] 田柳, 段慧敏. 乳腺癌术后局部复发的影响因素[J]. 实用临床医药杂志, 2017, 21(15): 219-220. doi: 10.7619/jcmp.201711078 [22] KLASSEN O, SCHMIDTM E, ULRICHC M, et al. Muscle strength in breast cancer patients receiving different treatment regimes[J]. J Cachexia Sarcopenia Muscle, 2017, 8(2): 305-316. doi: 10.1002/jcsm.12165
[23] RIBI K, LUO W X, BERNHARD J, et al. Adjuvant tamoxifen plus ovarian function suppression versus tamoxifen alone in premenopausal women with early breast cancer: patient-reported outcomes in the suppression of ovarian function trial[J]. J Clin Oncol, 2016, 34(14): 1601-1610. doi: 10.1200/JCO.2015.64.8675
[24] ZHANG W, ZHANGB L, HEJ J, et al. Clinicopathological characteristics and treatment of young women with breast cancer in China: a nationwide multicenter 10-year retrospective study[J]. Gland Surg, 2021, 10(1): 175-185. doi: 10.21037/gs-20-574
[25] OBERGUGGENBERGER A, MERANER V, SZTANKAY M, et al. Can we use gonadotropin plasma concentration as surrogate marker for BMI-related incomplete estrogen suppression in breast cancer patients receiving anastrozole?[J]. BMC Cancer, 2017, 17(1): 226. doi: 10.1186/s12885-017-3208-6
[26] FANG Q, GAN L, CHENY Y, et al. Percent body fat change in Chinese women after adjuvant chemotherapy for breast cancer[J]. Med Sci Monit, 2018, 24: 5988-5995. doi: 10.12659/MSM.911423
-
期刊类型引用(2)
1. 王存富,钱朋飞,曾懿,邱国芳,邓素华. 卵巢功能抑制联合芳香化酶抑制剂治疗绝经前乳腺癌的短期预后效果评价. 吉林医学. 2024(06): 1307-1310 .  百度学术
百度学术
2. 邱百怡,秦宗碧,蔡翔,孙邦梅. 玫瑰痤疮严重程度与血清睾酮、雌二醇水平及肠道菌群的关系研究. 实用临床医药杂志. 2023(10): 109-113 .  本站查看
本站查看
其他类型引用(0)




 下载:
下载:
 苏公网安备 32100302010246号
苏公网安备 32100302010246号
