Mechanism of docetaxel in treatment of choriocarcinoma based on network pharmacology
-
摘要:目的 基于网络药理学探讨多西他赛治疗绒毛膜癌的作用靶点及信号通路。方法 通过Genecards数据库收集多西他赛、绒毛膜癌的靶点。对绒毛膜癌疾病靶点以及多西他赛药物靶点进行映射,构建作用靶点的蛋白质互作(PPI)网络模型,筛选出排名前10的Hub基因。采用Cytoscape软件建立药物-疾病靶点的网络模型。利用DAVID数据库进行基因本体论(GO)功能富集分析和京都基因和基因组百科全书(KEGG)信号通路富集分析。结果 多西他赛、绒毛膜癌靶点分别为953、1 137个,多西他赛治疗绒毛膜癌的关键靶点包括TP53、AKT1、CASP8、STAT3等,涉及的主要KEGG通路富集分析确定信号通路包括癌症通路、细胞凋亡通路、Focal Adhesion通路、p53信号通路等。结论 多西他赛治疗绒毛膜癌是通过调节TP53、AKT1、STAT3等关键基因来调控癌症通路、细胞凋亡通路、p53信号通路等信号通路实现的。Abstract:Objective To explore the action target and signal pathway of docetaxel in treatment of choriocarcinoma based on network pharmacology.Methods The targets of docetaxel and choriocarcinoma were collected from Genecards database. The disease targets of choriocarcinoma and docetaxel drug targets were mapped, the protein-protein interaction (PPI) network model of target was constructed, and the top 10 hub genes were screened. The network model of drug-disease targets was established by Cytoscape software. DAVID database was used for gene ontology (GO) function enrichment analysis and Kyoto Encyclopedia of Genes and Genomes (KEGG) signal pathway enrichment analysis.Results A total of 953 and 1 137 targets were found for docetaxel and choriocarcinoma respectively, the key targets of docetaxel in the treatment of choriocarcinoma included TP53, AKT1, CASP8, STAT3 and etc. Determined signal paths found by KEGG pathway enrichment analysis involved cancer pathway, apoptosis pathway, Focal Adhesion pathway, p53 and other signaling pathways.Conclusion Docetaxel treating choriocarcinoma is achieved by regulating key genes such as TP53, AKT1 and STAT3 to regulate signaling pathways such as cancer pathway, apoptosis pathway and p53 pathway.
-
Keywords:
- docetaxel /
- choriocarcinoma /
- signaling pathways /
- network pharmacology /
- mechanism /
- action targets
-
绒毛膜癌(CC)简称绒癌,属于高度恶性滋养细胞肿瘤,有50%的妊娠CC发生在葡萄胎之后,其余的发生在自然流产和人工流产、正常足月妊娠或早产以及异位妊娠之后[1-2]。目前常用的化疗药物有甲氨蝶呤、环磷酞胺等,但这些化疗药物毒副作用大。多西他赛与紫杉醇都属于紫杉醇类药物,但多西他赛抗肿瘤活性更高,抗癌谱更广,其机制是加强微管蛋白聚合作用和抑制微管解聚作用,导致形成稳定的非功能性微管束,因而破坏肿瘤细胞的有丝分裂[3], 在临床中被广泛应用于治疗难治性卵巢癌等[4-7]。作者的前期体外实验[8]证实多西他赛能抑制CC细胞的增殖,诱导细胞凋亡并明显抑制其侵袭能力。研究[9]报道多西他赛能降低对常规化疗药物不敏感的CC患者血清人绒毛膜促性腺激素(HCG)水平,但多西他赛治疗CC的作用机制还缺乏深入研究。网络药理学融合了系统生物学、多向药理学和计算机信息学等多门学科,建立“药物-成分-基因-靶点-通路-疾病”的多层次网络关系,探索天然药物与复杂疾病的相互关系[10-11]。本研究基于前期实验研究和临床文献结果,采用网络药理学手段探索多西他赛治疗CC的潜在作用机制,现将结果报告如下。
1. 材料与方法
1.1 多西他赛、CC的靶点收集
在Genecards数据库(https://www.genecards.org/)中分别以“Docetaxol” “choriocarcinoma”为关键词检索靶点,并将其导入Excel表格中进行标准化处理,进行统计分析。
1.2 关键靶点筛选
将多西他赛所对应的靶点基因和CC相关的靶点基因进行映射,获得两者的共同基因,即多西他赛治疗CC的作用靶点。
1.3 蛋白质互作(PPI)网络构建
将筛选出的基因输入String 11.0数据库,将蛋白种类设置为人类(homo sapiens), “minimum required interaction score”参数设置为“highest confidence(0.900)”, 其余参数保持初始默认设置,导出PPI数据文件,建立蛋白与蛋白之间的网络。将结果导入Cytoscape软件,对结果进行可视化。
1.4 Hub基因筛选
通过Cytoscape软件的Cytohubba插件中的MCC算法,计算并筛选排名前10位的多西他赛治疗CC的Hub基因。
1.5 基因本体论(GO)富集和京都基因和基因组百科全书(KEGG)通路富集
将共同基因输入DAVID 6.7数据库(http://david.ncifcrf.gov/)进行GO富集分析和KEGG通路分析,研究多西他赛治疗CC的关键靶点的生物功能以及参与的信号通路,以P < 0.05和错误发现率(FDR) < 0.05作为筛选条件,筛选具有显著差异的生物过程和靶点通路。
2. 结果
2.1 靶点蛋白PPI网络的构建
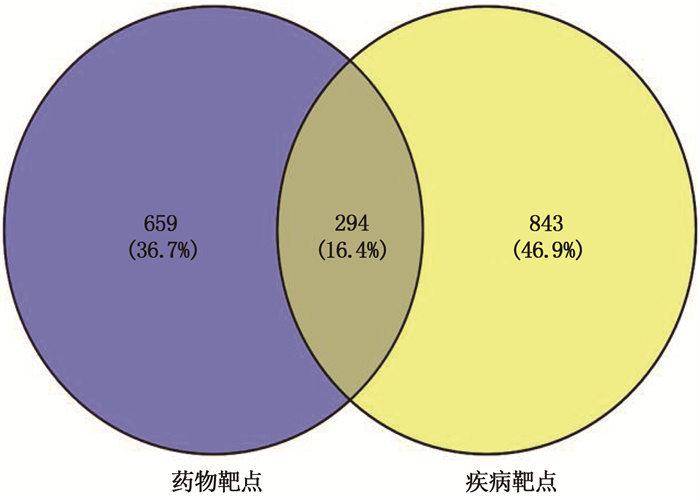
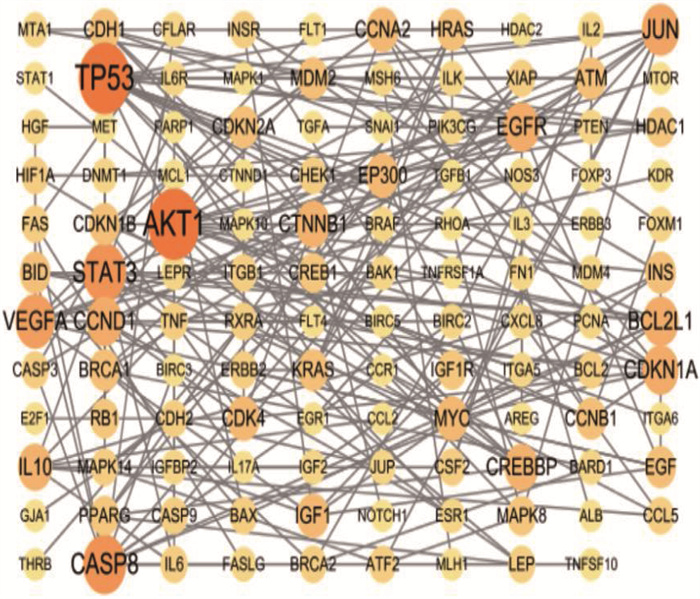
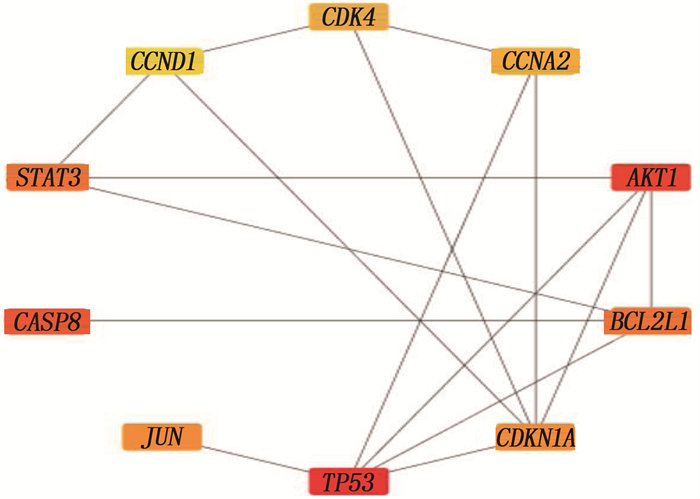
在Genecards数据库分别以“Docetaxol”和“choriocarcinoma”为关键词检索靶点,分别获得953和1 137个靶点,将1 137个疾病靶点与953个药物靶点输入Venny2.1软件绘制韦恩图,筛选出294个共同靶点,见图 1。将共同靶点在String 11.0平台分析的数据导入Cytoscape3.6.1软件,构建PPI网络模型。以Combined_score>0.9为筛选条件绘制PPI网络图,其中节点为靶点蛋白,边为各蛋白间互作关系,节点连接边数越多代表其在网络中作用越重要,见图 2。通过Cytoscape软件插件Cytohubba计算排名前10位的Hub基因,其中TP53、AKT1、CASP8、STAT3等是多西他赛治疗CC的关键基因。见图 3。
2.2 GO功能和KEGG富集分析
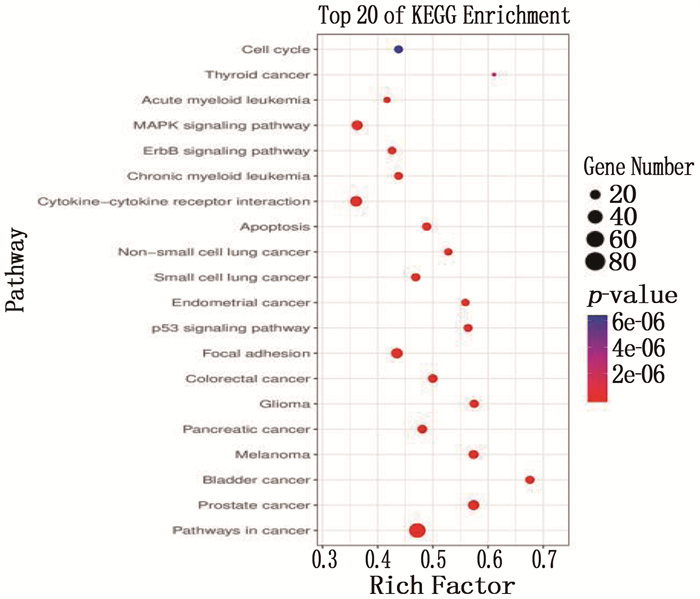
将294个预测靶点导入DAVID数据库中进行GO富集分析和KEGG通路分析。GO富集分析中,参与的生物过程有409个,主要包括调控细胞增殖(细胞增殖调节)、细胞凋亡(细胞凋亡负调控、细胞死亡的调控、程序性细胞死亡的调控)、信号传导(信号传导的正调控)、调节分子代谢(大分子代谢及合成过程的正调控、有机物质的反应等)。KEGG通路富集分析确定了28条相关信号通路,主要涉及癌症通路、细胞凋亡通路、Focal Adhesion通路和p53、ErbB、MAPK等信号通路。见图 4、图 5。
3. 讨论
CC属于恶性滋养细胞癌,是由滋养层滋养细胞增殖引起的恶性转化,导致这种转化的分子机制尚未确定。CC可继发于葡萄胎妊娠,也可继发于非葡萄胎妊娠,病情发展迅速,病死率高,主要通过血行播散,转移早且易扩散,肺是CC最易转移的部位,其次为阴道、盆腔等,转移部位皆有局部出血灶[1, 12]。
多西他赛也称多西紫杉醇,是紫杉醇类化学药物的衍生物,临床应用广泛,常被用于治疗难治性卵巢癌等,但其应用于CC方面的研究较少[4-6]。作者前期实验研究发现,多西他赛可以抑制CC细胞增殖的能力,并能诱导CC细胞凋亡,其作用浓度与时间呈正相关,并能明显抑制CC细胞体外侵袭的能力[8]。对高度化疗耐药的CC细胞,每周使用单剂多西他赛可快速降低HCG水平(超过95%), 且对人体毒性最小,但其作用机制有待进一步深入研究。
本研究结果发现,多西他赛可靶向P53、AKT1、STAT3、VEGFA等294个基因,参与细胞凋亡与增殖的调控、分子合成与代谢的调控等主要生物过程。抑癌基因TP53编码p53肿瘤蛋白,其能调节细胞周期和避免细胞癌变发生。任何导致TP53失活的突变都会引起其抑癌功能的丧失而导致癌症发生[13]。研究[14]发现女性TP53突变携带者罹患CC的风险更高,且易产生化疗耐药,因此靶向调控p53对于多西他赛治疗CC具有重要的临床价值。蛋白激酶B1(AKT1)是AKT的一个亚型,是生存信号通路PI3K/AKT的关键分子,与肿瘤细胞的生长、增殖、促进细胞侵袭和转移以及促进血管形成密切相关。研究[15]发现,在CC细胞系中,逆转AKT1表达可能通过抑制PI3K/AKT信号通路及靶向负调控VEGFA表达,最终抑制CC细胞增殖、迁移和侵袭。信号转导与转录激活因子3(STAT3)是一类具有信号转导及转录调控双重功能的蛋白质家族,激活后与DNA分子结合发挥作用[16]。多项研究[17-18]证实STAT3是参与恶性细胞转化的信号转导介质, IL-6/STAT3通路与CC细胞增殖密切相关,阻断STAT3信号通路能够抑制CC细胞的增殖,并诱导CC细胞凋亡。
研究[19-20]表明, p53信号通路与肿瘤发展及预后密切相关,其可以激活多条信号通路,阻碍细胞周期,诱导细胞凋亡,促进细胞衰老以及DNA修复过程,最终抑制肿瘤生长。研究[21]发现p53和p21CIP1是p53信号通路中重要的靶基因,在CC JEG-3细胞中,细胞周期蛋白依懒性激酶抑制剂p21CIPI表达被激活后,使G2细胞周期蛋白依赖性激酶CDK1表达显著降低,同时p53丝氨酸磷酸化水平增加, p53信号通路激活后使细胞周期阻滞在G2/M期,进而激活DNA损伤反应通路,抑制细胞增殖。
本研究借助网络药理学方法对多西他赛和CC进行靶标挖掘和通路分析,得到294个共同靶向基因和CC多条信号通路,包括TP53、AKT1、STAT3、VEGAF等基因以及细胞凋亡通路、p53通路等信号通路,证明了多西他赛可能通过调节多个靶基因、调控蛋白表达和信号传导通路而发挥对CC的治疗作用,初步揭示了多西他赛治疗CC的作用机制,为后续临床研究提供了新思路。
-
[1] SAVAGE J, ADAMS E, VERAS E, et al. Choriocarcinoma in women: analysis of a case series with genotyping[J]. Am J Surg Pathol, 2017, 41(12): 1593-1606. doi: 10.1097/PAS.0000000000000937
[2] ZHANG X, YAN K, CHEN J, et al. Using short tandem repeat analysis for choriocarcinoma diagnosis: a case series[J]. Diagn Pathol, 2019, 14(1): 93. doi: 10.1186/s13000-019-0866-5
[3] 李佳元, 李天虹. 多西他赛10倍稀释法脱敏试验的临床应用[J]. 中华护理杂志, 2008, 43(9): 849-850. doi: 10.3761/j.issn.0254-1769.2008.09.037 [4] 华金仁, 程慧明, 占戈兰, 等. 多西紫杉醇治疗卵巢癌的临床疗效及毒理研究[J]. 临床医药实践, 2021, 30(5): 323-326. https://www.cnki.com.cn/Article/CJFDTOTAL-SXLC202105001.htm [5] 彭涛. 六甲蜜胺联合多西他赛在铂耐药复发性上皮性卵巢癌化疗的临床观察[J]. 当代医学, 2021, 27(15): 151-152. doi: 10.3969/j.issn.1009-4393.2021.15.059 [6] HU Y J, IP P P C, CHAN K K L, et al. Ovarian clear cell carcinoma with choriocarcinomatous differentiation[J]. Int J Gynecol Pathol, 2010, 29(6): 539-545. doi: 10.1097/PGP.0b013e3181e7cc66
[7] WASEDA Y, KOMAI Y, YANO A, et al. Pathological complete response and two-year disease-free survival in a primary gastric choriocarcinoma patient with advanced liver metastases treated with germ cell tumor-based chemotherapy: a case report[J]. Jpn J Clin Oncol, 2012, 42(12): 1197-1201. doi: 10.1093/jjco/hys164
[8] 李岑. 紫杉醇对绒癌JEG-3细胞增殖、凋亡及侵袭能力的影响[D]. 长沙: 中南大学, 2009. [9] WINQUIST E, CAREY M. Activity of docetaxel in chemoresistant gestational choricarcinoma[J]. Gynecol Oncol, 2000, 79(3): 523-524. doi: 10.1006/gyno.2000.5990
[10] 吉兰芳, 王梦梦, 崔树娜. 基于网络药理学方法的二至丸治疗肝肾阴虚型崩漏作用机制研究[J]. 中国中医药信息杂志, 2020, 27(4): 78-86. https://www.cnki.com.cn/Article/CJFDTOTAL-XXYY202004017.htm [11] 林飞, 黄丹, 陈婷婷, 等. 基于网络药理学的黄芪-鸡血藤配伍治疗白细胞减少症作用机制研究[J]. 南京中医药大学学报, 2020, 36(6): 882-887. https://www.cnki.com.cn/Article/CJFDTOTAL-NJZY202006021.htm [12] GASPARRI R, SEDDA G, BRAMBILLA D, et al. When a differential diagnosis is fundamental: choriocarcinoma mimicking lung carcinoma[J]. J Clin Med, 2019, 8(11): 2018. doi: 10.3390/jcm8112018
[13] 胡才智, 胡春玲. 采用高通量测序技术检测肺癌致病突变及靶向药物突变位点[J]. 应用与环境生物学报, 2017, 23(1): 105-112. https://www.cnki.com.cn/Article/CJFDTOTAL-YYHS201701016.htm [14] 阎英, 张海波. 靶向Akt1小干扰RNA对人喉癌细胞增殖和凋亡的影响[J]. 中国当代医药, 2011, 18(36): 7-9, 13. doi: 10.3969/j.issn.1674-4721.2011.36.004 [15] 谢迎春, 邓丹, 张玉梅, 等. miR-503-5p靶向VEGFA基因通过PI3K/AKT信号通路调控人绒毛膜癌细胞增殖、迁移和侵袭[J]. 中国免疫学杂志, 2021, 37(6): 655-660. doi: 10.3969/j.issn.1000-484X.2021.06.004 [16] 王秀兰, 程玲瑗, 王博, 等. 磷酸化信号转导与转录激活因子3蛋白在结直肠癌中表达及临床意义的meta分析[J]. 山西医药杂志, 2018, 47(1): 24-27. doi: 10.3969/j.issn.0253-9926.2018.01.007 [17] PENG Z, ZHANG C, ZHOU W, et al. The STAT3/NFIL3 signaling axis-mediated chemotherapy resistance is reversed by Raddeanin A via inducing apoptosis in choriocarcinoma cells[J]. J Cell Physiol, 2018, 233(7): 5370-5382. doi: 10.1002/jcp.26362
[18] FITZGERALD J S, TSAREVA S A, POEHLMANN T G, et al. Leukemia inhibitory factor triggers activation of signal transducer and activator of transcription 3, proliferation, invasiveness, and altered protease expression in choriocarcinoma cells[J]. Int J Biochem Cell Biol, 2005, 37(11): 2284-2296. doi: 10.1016/j.biocel.2005.02.025
[19] ZHENG W, LIU T, SUN R, et al. Daidzein induces choriocarcinoma cell apoptosis in a dose-dependent manner via the mitochondrial apoptotic pathway[J]. Mol Med Rep, 2018, 17(4): 6093-6099.
[20] 徐文达, 高平, 杨文君. p53信号通路与肿瘤关系的研究进展[J]. 宁夏医科大学学报, 2012, 34(9): 971-976. doi: 10.3969/j.issn.1674-6309.2012.09.045 [21] DRUKTEINIS J S, MEDRANO T, ABLORDEPPEY E A, et al. Benzo[a]Pyrene, but not 2, 3, 7, 8-TCDD, induces G2/M cell cycle arrest, p21CIP1 and p53 phosphorylation in human choriocarcinoma JEG-3 cells: a distinct signaling pathway[J]. Placenta, 2005, 26: S87-S95. doi: 10.1016/j.placenta.2005.01.013
-
期刊类型引用(1)
1. 卢俊伟,祝璟哲,陈鸿儒,解举民. 基于网络药理学与分子对接技术探究木犀草素治疗宫颈癌的分子机制. 实用临床医药杂志. 2024(16): 26-33 .  本站查看
本站查看
其他类型引用(1)




 下载:
下载:

 苏公网安备 32100302010246号
苏公网安备 32100302010246号
