Analysis in performance of GM(1, 1) model in predicting blood glucose at different ranges
-
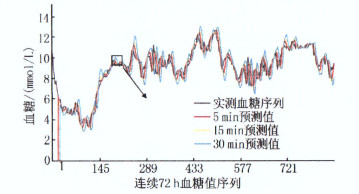
摘要:目的 评价GM (1,1)模型在血糖预测中的性能,分析该模型对不同范围血糖数据的预测能力。方法 以50例2型糖尿病(T2DM)患者的连续72 h血糖序列为研究对象,基于新陈代谢算法建立GM (1,1)模型,预测5、15、30 min后的血糖。将50例患者随机分成对照组20例和实验组30例,观察分析对照组数据得到预测误差较低时的血糖范围(a~b),以此范围将实验组数据分为A组(< a)、B组(a~b)、C组(>b),采用Pearson相关性分析、非参数检验进行分析。结果 对照组筛选出预测时长为5、15、30 min时的血糖范围分别为3.4~11.5、3.3~11.4、3.2~11.4 mmol/L。相关性分析显示,不同预测时长时,B组的预测拟合度均最好(P < 0.01)。非参数检验表明,同一预测时长的组间预测误差比较,差异有统计学意义(P < 0.01),其中A组的预测误差最小,B组次之,C组最大。结论 GM (1,1)模型对3.4~11.4 mmol/L的血糖数据预测效果更好。
-
关键词:
- GM(1, 1)模型 /
- 2型糖尿病 /
- 血糖预测 /
- 血糖范围
Abstract:Objective To evaluate performance of GM (1, 1) model in predicting blood glucose, and the predictive ability of this model for prediction of different blood glucose ranges.Methods Seventy-two-hour blood glucose sequence of fifty patients with T2DM was selected as study objects. GM (1, 1) model was established based on the metabolic algorithm to predict blood glucose levels after 5, 15 and 30 min. Fifty patients were randomly divided into control group(n=20) and experimental group(n=30). The blood glucose range(ranging from a to b) when the prediction error was low in the control group was obtained. According to the blood glucose range of the control group, the data of the experimental group was divided into group A(< a), group B(a to b), and group C(>b). Analysis was performed by Pearson correlation analysis and nonparametric test.Results The blood glucose ranges for prediction duration of 5 min, 15 min and 30 min in the control group were 3.4 to 11.5 mmol/L, 3.3 to 11.4 mmol/L and 3.2 to 11.4 mmol/L, respectively. Correlation analysis showed that group B at differed prediction durations had the best predictive fit (P < 0.01). Nonparametric tests indicated that there was a statistical difference in prediction error between groups at the same prediction duration (P < 0.01), and the group A had the minimum error, followed by group B, and group C had the maximum error.Conclusion GM (1, 1) model has better predictive efficacy at blood glucose range of 3.4 to 11.4 mmol/L. -
绒毛膜癌(CC)简称绒癌,属于高度恶性滋养细胞肿瘤,有50%的妊娠CC发生在葡萄胎之后,其余的发生在自然流产和人工流产、正常足月妊娠或早产以及异位妊娠之后[1-2]。目前常用的化疗药物有甲氨蝶呤、环磷酞胺等,但这些化疗药物毒副作用大。多西他赛与紫杉醇都属于紫杉醇类药物,但多西他赛抗肿瘤活性更高,抗癌谱更广,其机制是加强微管蛋白聚合作用和抑制微管解聚作用,导致形成稳定的非功能性微管束,因而破坏肿瘤细胞的有丝分裂[3], 在临床中被广泛应用于治疗难治性卵巢癌等[4-7]。作者的前期体外实验[8]证实多西他赛能抑制CC细胞的增殖,诱导细胞凋亡并明显抑制其侵袭能力。研究[9]报道多西他赛能降低对常规化疗药物不敏感的CC患者血清人绒毛膜促性腺激素(HCG)水平,但多西他赛治疗CC的作用机制还缺乏深入研究。网络药理学融合了系统生物学、多向药理学和计算机信息学等多门学科,建立“药物-成分-基因-靶点-通路-疾病”的多层次网络关系,探索天然药物与复杂疾病的相互关系[10-11]。本研究基于前期实验研究和临床文献结果,采用网络药理学手段探索多西他赛治疗CC的潜在作用机制,现将结果报告如下。
1. 材料与方法
1.1 多西他赛、CC的靶点收集
在Genecards数据库(https://www.genecards.org/)中分别以“Docetaxol” “choriocarcinoma”为关键词检索靶点,并将其导入Excel表格中进行标准化处理,进行统计分析。
1.2 关键靶点筛选
将多西他赛所对应的靶点基因和CC相关的靶点基因进行映射,获得两者的共同基因,即多西他赛治疗CC的作用靶点。
1.3 蛋白质互作(PPI)网络构建
将筛选出的基因输入String 11.0数据库,将蛋白种类设置为人类(homo sapiens), “minimum required interaction score”参数设置为“highest confidence(0.900)”, 其余参数保持初始默认设置,导出PPI数据文件,建立蛋白与蛋白之间的网络。将结果导入Cytoscape软件,对结果进行可视化。
1.4 Hub基因筛选
通过Cytoscape软件的Cytohubba插件中的MCC算法,计算并筛选排名前10位的多西他赛治疗CC的Hub基因。
1.5 基因本体论(GO)富集和京都基因和基因组百科全书(KEGG)通路富集
将共同基因输入DAVID 6.7数据库(http://david.ncifcrf.gov/)进行GO富集分析和KEGG通路分析,研究多西他赛治疗CC的关键靶点的生物功能以及参与的信号通路,以P < 0.05和错误发现率(FDR) < 0.05作为筛选条件,筛选具有显著差异的生物过程和靶点通路。
2. 结果
2.1 靶点蛋白PPI网络的构建
在Genecards数据库分别以“Docetaxol”和“choriocarcinoma”为关键词检索靶点,分别获得953和1 137个靶点,将1 137个疾病靶点与953个药物靶点输入Venny2.1软件绘制韦恩图,筛选出294个共同靶点,见图 1。将共同靶点在String 11.0平台分析的数据导入Cytoscape3.6.1软件,构建PPI网络模型。以Combined_score>0.9为筛选条件绘制PPI网络图,其中节点为靶点蛋白,边为各蛋白间互作关系,节点连接边数越多代表其在网络中作用越重要,见图 2。通过Cytoscape软件插件Cytohubba计算排名前10位的Hub基因,其中TP53、AKT1、CASP8、STAT3等是多西他赛治疗CC的关键基因。见图 3。
2.2 GO功能和KEGG富集分析
将294个预测靶点导入DAVID数据库中进行GO富集分析和KEGG通路分析。GO富集分析中,参与的生物过程有409个,主要包括调控细胞增殖(细胞增殖调节)、细胞凋亡(细胞凋亡负调控、细胞死亡的调控、程序性细胞死亡的调控)、信号传导(信号传导的正调控)、调节分子代谢(大分子代谢及合成过程的正调控、有机物质的反应等)。KEGG通路富集分析确定了28条相关信号通路,主要涉及癌症通路、细胞凋亡通路、Focal Adhesion通路和p53、ErbB、MAPK等信号通路。见图 4、图 5。
3. 讨论
CC属于恶性滋养细胞癌,是由滋养层滋养细胞增殖引起的恶性转化,导致这种转化的分子机制尚未确定。CC可继发于葡萄胎妊娠,也可继发于非葡萄胎妊娠,病情发展迅速,病死率高,主要通过血行播散,转移早且易扩散,肺是CC最易转移的部位,其次为阴道、盆腔等,转移部位皆有局部出血灶[1, 12]。
多西他赛也称多西紫杉醇,是紫杉醇类化学药物的衍生物,临床应用广泛,常被用于治疗难治性卵巢癌等,但其应用于CC方面的研究较少[4-6]。作者前期实验研究发现,多西他赛可以抑制CC细胞增殖的能力,并能诱导CC细胞凋亡,其作用浓度与时间呈正相关,并能明显抑制CC细胞体外侵袭的能力[8]。对高度化疗耐药的CC细胞,每周使用单剂多西他赛可快速降低HCG水平(超过95%), 且对人体毒性最小,但其作用机制有待进一步深入研究。
本研究结果发现,多西他赛可靶向P53、AKT1、STAT3、VEGFA等294个基因,参与细胞凋亡与增殖的调控、分子合成与代谢的调控等主要生物过程。抑癌基因TP53编码p53肿瘤蛋白,其能调节细胞周期和避免细胞癌变发生。任何导致TP53失活的突变都会引起其抑癌功能的丧失而导致癌症发生[13]。研究[14]发现女性TP53突变携带者罹患CC的风险更高,且易产生化疗耐药,因此靶向调控p53对于多西他赛治疗CC具有重要的临床价值。蛋白激酶B1(AKT1)是AKT的一个亚型,是生存信号通路PI3K/AKT的关键分子,与肿瘤细胞的生长、增殖、促进细胞侵袭和转移以及促进血管形成密切相关。研究[15]发现,在CC细胞系中,逆转AKT1表达可能通过抑制PI3K/AKT信号通路及靶向负调控VEGFA表达,最终抑制CC细胞增殖、迁移和侵袭。信号转导与转录激活因子3(STAT3)是一类具有信号转导及转录调控双重功能的蛋白质家族,激活后与DNA分子结合发挥作用[16]。多项研究[17-18]证实STAT3是参与恶性细胞转化的信号转导介质, IL-6/STAT3通路与CC细胞增殖密切相关,阻断STAT3信号通路能够抑制CC细胞的增殖,并诱导CC细胞凋亡。
研究[19-20]表明, p53信号通路与肿瘤发展及预后密切相关,其可以激活多条信号通路,阻碍细胞周期,诱导细胞凋亡,促进细胞衰老以及DNA修复过程,最终抑制肿瘤生长。研究[21]发现p53和p21CIP1是p53信号通路中重要的靶基因,在CC JEG-3细胞中,细胞周期蛋白依懒性激酶抑制剂p21CIPI表达被激活后,使G2细胞周期蛋白依赖性激酶CDK1表达显著降低,同时p53丝氨酸磷酸化水平增加, p53信号通路激活后使细胞周期阻滞在G2/M期,进而激活DNA损伤反应通路,抑制细胞增殖。
本研究借助网络药理学方法对多西他赛和CC进行靶标挖掘和通路分析,得到294个共同靶向基因和CC多条信号通路,包括TP53、AKT1、STAT3、VEGAF等基因以及细胞凋亡通路、p53通路等信号通路,证明了多西他赛可能通过调节多个靶基因、调控蛋白表达和信号传导通路而发挥对CC的治疗作用,初步揭示了多西他赛治疗CC的作用机制,为后续临床研究提供了新思路。
-
表 1 2组T2DM患者一般资料比较(x±s)[n(%)]
指标 对照组(n=20) 实验组(n=30) 年龄/岁 50.6±9.4 51.0±9.3 性别 男 11(55.0) 17(56.7) 女 9(45.0) 13(43.3) 病程/年 9.7±4.9 9.3±4.7 BMI/(kg/m2) 22.0±1.1 22.8±1.3 HbA1c/% 8.2±1.2 8.5±2.2 BMI: 体质量指数; HbA1c: 糖化血红蛋白。 表 2 不同预测时长实测值与预测值的误差分析
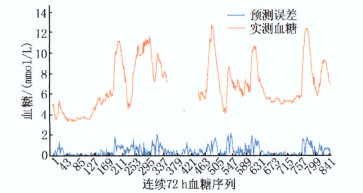
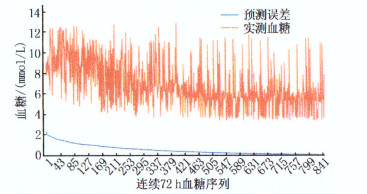
误差指标 预测时长 5 min 15 min 30 min MRE/% 6.10 9.00 13.10 MAE 0.46 0.68 1.01 RMSE 0.69 0.92 1.26 MRE: 平均相对误差; MAE: 平均绝对误差;
RMSE: 均方根误差。表 3 患者乙不同预测时长的目标血糖范围与最大绝对误差
项目 5 min 15 min 30 min 目标血糖范围/(mmol/L) 最大绝对误差 目标血糖范围/(mmol/L) 最大绝对误差 目标血糖范围/(mmol/L) 最大绝对误差 符合要求项 3.4~6.9 0.43 3.4~6.7 0.63 3.4~6.7 0.66 9.3~10.4 0.44 7.2~11.0 0.59 9.3~10.4 0.79 7.8~8.8 0.39 9.3~10.4 0.55 5.3~6.9 0.80 5.3~7.0 0.36 5.3~6.9 0.45 4.8~6.2 0.61 4.8~6.2 0.44 4.8~6.4 0.63 4.3~5.2 0.51 4.3~5.7 0.38 4.3~5.7 0.56 5.9~8.2 0.93 6.4~8.2 0.45 0.54 合集 3.4~7.0 - 3.4~11.0 - 3.4~8.2 - 7.8~8.8 9.3~10.4 9.3~10.4 表 4 对照组患者不同预测时长的目标血糖范围与最大绝对误差
患者编号 目标血糖范围/(mmol/L) 最大绝对误差 5 min 15 min 30 min 5 min 15 min 30 min 1 3.4~6.5 3.4~7.4 3.4~7.4 0.41 0.61 0.86 2 4.9~7.1 4.9~7.1 4.9~7.3 0.42 0.59 0.94 3 5.5~8.7 5.5~8.7 5.8~8.7 0.41 0.61 0.94 4 3.4~4.6 3.4~4.6 3.2~4.9 0.44 0.64 0.97 5.4~8.7 5.4~8.7 5.4~8.7 5 5.4~7.8 5.4~7.7 5.4~7.7 0.45 0.65 0.75 6 6.7~7.5 6.3~7.5 6.3~7.5 0.41 0.46 0.66 7 3.4~7.0 3.4~11.0 3.4~6.9 0.44 0.63 0.80 7.8~8.8 9.3~10.4 9.3~10.4 8 5.6~8.0 3.3~4.9 3.3~5.0 0.42 0.61 0.93 5.6~7.8 5.5~7.8 9 4.2~7.4 4.3~7.4 4.2~7.9 0.39 0.63 0.95 10 4.5~5.8 4.5~6.0 4.5~6.0 0.42 0.57 0.83 7.8~10.2 7.9~10.2 8.2~9.7 10.9~11.4 10.9~11.4 10.9~11.4 11 8.2~9.2 8.2~11.3 8.2~10.8 0.44 0.65 0.92 12 5.2~6.9 5.2~6.9 5.2~6.9 0.43 0.53 0.68 13 6.1~9.0 6.1~8.5 5.6~8.2 0.42 0.65 0.91 14 4.7~7.7 4.7~7.0 4.6~7.5 0.39 0.60 0.89 15 4.4~8.2 4.4~10.0 4.4~9.9 0.42 0.61 0.90 8.7~10.0 16 3.4~6.2 3.4~6.2 3.4~7.9 0.43 0.57 0.89 6.9~8.7 6.9~8.6 17 5.3~8.5 5.3~8.5 5.2~8.7 0.44 0.62 0.94 18 6.7~9.9 6.3~11.3 6.2~11.3 0.44 0.66 0.92 10.5~11.5 19 6.1~7.0 6.1~7.0 6.5~7.7 0.45 0.63 0.94 8.1~10.6 8.1~10.6 8.1~10.6 20 5.1~8.4 5.1~8.5 5.1~8.3 0.45 0.62 0.83 合集 3.4~11.5 3.3~11.4 3.2~11.4 - - - 表 5 不同预测时长、不同血糖范围的相关性分析及MAE结果
预测时长 组别 对数 r P MAE 5 min A1组 324 0.468 < 0.001 0.37 B1组 23 082 0.937 < 0.001 0.44 C1组 1 974 0.873 < 0.001 0.87 15 min A2组 290 0.375 < 0.001 0.51 B2组 22 967 0.875 < 0.001 0.64 C2组 2 063 0.770 < 0.001 1.34 30 min A3组 255 0.189 0.002 0.71 B3组 22 925 0.773 < 0.001 0.94 C3组 2 050 0.631 < 0.001 2.07 A1组: 血糖 < 3.4 mmol/L组; B1组: 血糖3.4~11.5 mmol/L组; C1组: 血糖>11.5 mmol/L组; A2组: 血糖 < 3.3 mmol/L组; B2组: 血糖3.3~11.4 mmol/L组; C2组: 血糖>11.4 mmol/L组; A3组: 血糖 < 3.2 mmol/L组; B3组: 血糖3.2~11.4 mmol/L组; C3组: 血糖>11.4 mmol/L组; MAE: 平均绝对误差。 表 6 不同预测时长、不同血糖范围的非参数检验
预测时长 组别 绝对误差中位数 多个独立样本的非参数检验 组间比较 P 5 min A1组 0.21 A1组与B1组 0.001 B1组 0.27 B1组与C1组 < 0.001 C1组 0.61 A1组与C1组 < 0.001 15 min A2组 0.30 A2组与B2组 < 0.001 B2组 0.39 B2组与C2组 < 0.001 C2组 0.93 A2组与C2组 < 0.001 30 min A3组 0.39 A3组与B3组 < 0.001 B3组 0.57 B3组与C3组 < 0.001 C3组 1.38 A3组与C3组 < 0.001 A1组: 血糖 < 3.4 mmol/L组; B1组: 血糖3.4~11.5 mmol/L组; C1组: 血糖>11.5 mmol/L组; A2组: 血糖 < 3.3 mmol/L组; B2组: 血糖3.3~11.4 mmol/L组; C2组: 血糖>11.4 mmol/L组; A3组: 血糖 < 3.2 mmol/L组; B3组: 血糖3.2~11.4 mmol/L组; C3组: 血糖>11.4 mmol/L组。 -
[1] AKBAS E M, DEMIRTAS L, OZCICEK A, et al. Association of epicardial adipose tissue, neutrophil-to-lymphocyte ratio and platelet-to-lymphocyte ratio with diabetic nephropathy[J]. Int J Clin Exp Med, 2014, 7(7): 1794-1801. http://europepmc.org/abstract/MED/25126182
[2] 中华医学会糖尿病学分会. 中国2型糖尿病防治指南(2017年版)[J]. 中国实用内科杂志, 2018, 38(4): 292-344. https://www.cnki.com.cn/Article/CJFDTOTAL-SYNK201804009.htm [3] Seuring T, Archangelidi O, Suhrcke M. The economic costs of type 2 diabetes: a global systematic review[J]. Pharmacoeconomics, 2015, 33(8): 811-831. doi: 10.1007/s40273-015-0268-9
[4] SAITI K, MACAŠ M, LHOTSKÁ L, et al. Ensemble methods in combination with compartment models for blood glucose level prediction in type 1 diabetes mellitus[J]. Comput Methods Programs Biomed, 2020, 196: 105628. doi: 10.1016/j.cmpb.2020.105628
[5] HE J, WANG Y. Blood glucose concentration prediction based on kernel canonical correlation analysis with particle swarm optimization and error compensation[J]. Comput Methods Programs Biomed, 2020, 196: 105574. doi: 10.1016/j.cmpb.2020.105574
[6] 都承华, 龚谊承. 基于支持向量回归和核岭回归对血糖值预测的对比分析[J]. 数学的实践与认识, 2020, 50(6): 132-139. https://www.cnki.com.cn/Article/CJFDTOTAL-SSJS202006013.htm [7] 王延年, 郭占丽, 袁进磊, 等. 基于自适应噪声完整聚合经验模态分解-极限学习机的短期血糖预测[J]. 中国生物医学工程学报, 2017, 36(6): 702-710. doi: 10.3969/j.issn.0258-8021.2017.06.010 [8] 邓聚龙. 灰色系统理论教程[M]. 武汉: 华中理工大学出版社, 1990: 122-123. [9] 覃伟, 高敏, 沈莹, 等. 基于机器学习算法的2型糖尿病患者3个月血糖预测[J]. 中华疾病控制杂志, 2019, 23(11): 1313-1317. https://www.cnki.com.cn/Article/CJFDTOTAL-JBKZ201911003.htm [10] WANG Y, WEI F, SUN C, et al. The Research of Improved Grey GM(1, 1) Model to Predict the Postprandial Glucose in Type 2 Diabetes[J]. Biomed Res Int, 2016, 2016: 6837052. http://europepmc.org/articles/PMC4893588/
[11] 龚谊承, 都承华, 张艳娜, 等. 基于主成分和GBDT对血糖值的预测[J]. 数学的实践与认识, 2019, 49(14): 116-122. https://www.cnki.com.cn/Article/CJFDTOTAL-SSJS201914013.htm [12] VOELKER R. "artificial pancreas" is approved[J]. JAMA, 2016, 316(19): 1957. http://www.ncbi.nlm.nih.gov/pubmed/27838705
[13] KOVATCHEV B, CHENG P, ANDERSON S M, et al. Feasibility of long-term closed-loop control: a multicenter 6-month trial of 24/7 automated insulin delivery[J]. Diabetes Technol Ther, 2017, 19(1): 18-24. doi: 10.1089/dia.2016.0333
[14] SCHVTZ-FUHRMANN I, SCHVTZ A K, EICHNER M, et al. Two subsequent pregnancies in a woman with type 1 diabetes: artificial pancreas was a gamechanger[J]. J Diabetes Sci Technol, 2020, 14(5): 972-973. doi: 10.1177/1932296820906219
[15] THABIT H, HARTNELL S, ALLEN J M, et al. Closed-loop insulin delivery in inpatients with type 2 diabetes: a randomised, parallel-group trial[J]. Lancet Diabetes Endocrinol, 2017, 5(2): 117-124. doi: 10.1016/S2213-8587(16)30280-7
[16] QUINTAL A, MESSIER V, RABASA-LHORET R, et al. A critical review and analysis of ethical issues associated with the artificial pancreas[J]. Diabetes Metab, 2019, 45(1): 1-10. doi: 10.1016/j.diabet.2018.04.003
[17] RAMLI R, REDDY M, OLIVER N. Artificial pancreas: current progress and future outlook in the treatment of type 1 diabetes[J]. Drugs, 2019, 79(10): 1089-1101. doi: 10.1007/s40265-019-01149-2
[18] BLAUW H, KEITH-HYNES P, KOOPS R, et al. A review of safety and design requirements of the artificial pancreas[J]. Ann Biomed Eng, 2016, 44(11): 3158-3172. doi: 10.1007/s10439-016-1679-2
[19] QIN Y F, XIAO J, CHEN X D. Physiological model and chemical modeling strategy for blood glucose prediction[J]. Chemical Industry and Engineering Progress, 2019, 38(1): 545-555.
[20] OVIEDO S, VEHÍ J, CALM R, et al. A review of personalized blood glucose prediction strategies for T1DM patients[J]. Int J Numer Meth Biomed Engng, 2017, 33(6): e2833. doi: 10.1002/cnm.2833
-
期刊类型引用(1)
1. 卢俊伟,祝璟哲,陈鸿儒,解举民. 基于网络药理学与分子对接技术探究木犀草素治疗宫颈癌的分子机制. 实用临床医药杂志. 2024(16): 26-33 .  本站查看
本站查看
其他类型引用(1)





 下载:
下载:




 苏公网安备 32100302010246号
苏公网安备 32100302010246号
